DNA 微陣列(通常也稱為DNA晶片或生物晶片)是附著在固體表面上的微觀 DNA 點的集合。科學家利用 DNA微陣列同時測量大量基因的表現量或對基因組的多個區域進行基因分型。每個 DNA 點含有數皮摩爾(10−12摩爾 )的特定 DNA 序列,稱為探針(或報告基因或寡核苷酸)。這些可以是基因或其他 DNA 元素的短片段,用於在高嚴格條件下與cDNA或 cRNA(也稱為反義 RNA)樣本(稱為目標)雜交。探針-標靶雜交通常透過檢測螢光團、銀或化學發光標記的標靶來檢測和定量,以確定標靶中核酸序列的相對豐度。最初的核酸陣列是大約 9 公分 × 12 公分的宏陣列,第一個基於電腦影像的分析於1981年發表。其應用的一個例子是用於心血管疾病、癌症、病原體和 GWAS 分析的多態性的 SNP 陣列。它也用於識別結構變異和測量基因表現。
原則

微陣列背後的核心原理是兩條DNA鏈之間的雜交,即互補核酸序列透過在互補核苷酸鹼基對之間形成氫鍵而彼此特異性配對的特性。核苷酸序列中互補鹼基對的數量越多,代表兩條鏈之間的非共價鍵越緊密。洗掉非特異性結合序列後,只有強配對的鏈才會維持雜交狀態。與探針序列結合的螢光標記標靶序列會產生取決於雜交條件(如溫度)和雜交後清洗的訊號。來自一個點(特徵)的訊號的總強度取決於與該點上的探針結合的目標樣本的量。微陣列採用相對定量方法,將某一特徵的強度與不同條件下相同特徵的強度進行比較,並透過其位置了解特徵的身份。

用途和類型

陣列有許多種類型,最明顯的差異就是它們在空間上排列在表面上還是排列在編碼珠上:
- 傳統的固相陣列是一組有序的微觀“點”,稱為特徵,每個點都有數千個相同且特定的探針附著在固體表面,例如玻璃、塑膠或矽 生物晶片(俗稱基因組晶片,DNA晶片或基因陣列)。數千個這樣的特徵可以被放置在單一 DNA 微陣列上的已知位置。
- 替代的珠陣列是一組微觀聚苯乙烯珠,每個珠子都有特定的探針和兩種或多種染料的比例,這些染料不會幹擾目標序列上使用的螢光染料。
DNA微陣列可用於檢測DNA(如比較基因組雜交),或檢測可能翻譯成或不翻譯成蛋白質的RNA(最常見的是逆轉錄後的cDNA )。透過 cDNA 測量基因表現的過程稱為表現分析或表現譜。
應用包括:
| 應用或技術 | 概要 |
|---|---|
| 基因表現譜 | 在mRNA或基因表達分析實驗中,同時監測數千個基因的表達水平,以研究某些治療、疾病和發育階段對基因表現的影響。例如,基於微陣列的基因表現譜可透過比較受感染細胞或組織與未受感染細胞或組織中的基因表現來識別因病原體或其他生物體而改變表現的基因。 [ 2 ] |
| 比較基因組雜交 | 評估不同細胞或密切相關生物體的基因組內容,正如史丹佛大學的Patrick Brown、Jonathan Pollack、Ash Alizadeh及其同事最初所描述的。[ 3 ] [ 4 ] |
| 基因辨識 | 小型微陣列用於檢查食品和飼料中的生物(如基因改造生物 [1])、細胞培養中的支原體或疾病檢測的病原體的身份,主要結合PCR和微陣列技術。 |
| 晶片上的染色質免疫沉澱 | 可以透過免疫沉澱某種蛋白質( ChIP )來分離與該蛋白質結合的 DNA 序列,然後可以將這些片段雜交到微陣列(例如平鋪陣列)上,從而確定整個基因組中蛋白質結合位點的佔有率。免疫沉澱的範例蛋白包括組蛋白修飾(H3K27me3、H3K4me2、H3K9me3 等)、多梳蛋白組(PRC2:Suz12、PRC1:YY1)和三胸蛋白組(Ash1),用於研究表觀遺傳景觀,或RNA聚合酶II用於研究轉錄。 |
| 大壩ID | 類似於ChIP,可以分離目的蛋白質結合的基因組區域,並用於探測微陣列以確定結合位點佔有率。與 ChIP 不同,DamID 不需要抗體,而是利用蛋白質結合位點附近的腺嘌呤甲基化來選擇性擴增這些區域,透過表達與細菌DNA 腺嘌呤甲基轉移酶融合的微量目的蛋白質來引入。 |
| SNP 檢測 | 辨識種群內或種群間等位基因的單核苷酸多態性。 [ 5 ]微陣列的許多應用都利用了 SNP 檢測,包括基因分型、法醫分析、測量疾病易感性、識別候選藥物、評估個體中的種系突變或癌症中的體細胞突變、評估雜合性缺失或遺傳連鎖分析。 |
| 可變剪接檢測 | 外顯子連接陣列設計使用針對基因預測外顯子的預期或潛在剪接位點的特定探針。它的密度或覆蓋率中等,為典型的基因表現陣列(每個基因有 1-3 個探針)和基因組平鋪陣列(每個基因有數百或數千個探針)。它用於檢測基因替代剪接形式的表達。外顯子陣列具有不同的設計,採用設計用於檢測已知或預測基因的每個外顯子的探針,並且可用於檢測不同的剪接異構體。 |
| 融合基因微陣列 | 融合基因微陣列可以檢測融合轉錄本,例如來自癌症樣本的融合轉錄物。背後的原理是建立在可變剪接微陣列的基礎上。寡核苷酸設計策略可以實現嵌合轉錄連接點的測量與單一融合夥伴的外顯子測量的綜合。 |
| 平鋪陣列 | 基因組平鋪陣列由重疊的探針組成,旨在密集地代表感興趣的基因組區域,有時該區域大到與整個人類染色體一樣大。目的是透過經驗檢測以前可能未知或未預測到的 轉錄本表達或剪接形式。 |
| 雙股 B-DNA 微陣列 | 右手雙股 B-DNA 微陣列可用於表徵新型藥物和生物製劑,這些藥物和生物製劑可用於結合固定的完整雙股 DNA 的特定區域。這種方法可以用來抑制基因表現。[ 6 ] [ 7 ]它們也能在不同環境條件下表徵其結構。 |
| 雙股 Z-DNA 微陣列 | 左手雙股 Z-DNA 微陣列可用於辨識位於右手 B-DNA 基因較長片段內的替代 Z-DNA 結構的短序列(例如,轉錄增強、重組、RNA 編輯)。[ 6 ] [ 7 ]微陣列也能表徵不同環境條件下的其結構。 |
| 多鏈 DNA 微陣列(三鏈 DNA 微陣列與四鏈 DNA 微陣列) | 多鏈 DNA 和 RNA 微陣列可用於識別與這些多鏈核酸序列結合的新藥物。這種方法可用於發現具有抑制基因表現能力的新藥物和生物製劑。[ 6 ] [ 7 ] [ 8 ] [ 9 ]這些微陣列也可以表徵不同環境條件下的其結構。 |
針對特定作物量身訂製的專用陣列在分子育種應用中越來越受歡迎。將來它們可以用於早期篩選幼苗,以降低育種過程中試驗的不需要的幼苗的數量。 [ 10 ]
製造
微陣列可以採用不同的方式製造,具體取決於所檢查的探針的數量、成本、客製化要求以及所提出的科學問題的類型。商業供應商提供的陣列可能只有 10 個探針,也可能有 500 萬個或更多的微米級探針。
點陣列與原位合成陣列
微陣列可以透過多種技術來製造,包括用細尖針在玻璃載玻片上列印、使用預製遮罩的光刻、使用動態微鏡裝置的光刻、噴墨列印、[ 11 ] [ 12 ]或在微電極陣列上進行 電化學反應
在斑點微陣列中,探針是寡核苷酸,cDNA或與mRNA相對應的PCR產物的小片段。探針在沉積到陣列表面之前進行合成,然後“點”到玻璃上。一種常見的方法是利用機械手臂控制的細針或針頭陣列,將其浸入含有 DNA 探針的孔中,然後將每個探針放置在陣列表面的指定位置。所得到的探針「網格」代表了所製備探針的核酸譜,可以接收來自實驗或臨床樣本的互補 cDNA 或 cRNA「標靶」。世界各地的研究科學家都採用這項技術在自己的實驗室中生產「內部」印刷微陣列。這些陣列可以輕鬆地針對每個實驗進行定制,因為研究人員可以選擇陣列上的探針和列印位置,在自己的實驗室(或合作機構)中合成探針,並定位陣列。然後,他們可以產生自己的標記樣本進行雜交,將樣本雜交到陣列上,最後用自己的裝置掃描陣列。這提供了一種相對低成本的微陣列,可以根據每個研究進行定制,並避免了購買通常更昂貴的商業陣列的成本,這些陣列可能代表大量研究人員不感興趣的基因。有出版物表明,內部製造的斑點微陣列可能無法提供與商業寡核苷酸陣列相同水平的靈敏度[ 13 ] ,可能是因為與工業生產的寡核苷酸陣列相比,其批量較小且印刷效率較低。
在寡核苷酸微陣列中,探針是被設計用來與已知或預測的開放閱讀框序列的部分相符的短序列。儘管寡核苷酸探針經常用於「點狀」微陣列,但術語「寡核苷酸陣列」通常指特定的製造技術。寡核苷酸陣列是透過列印代表單一基因或基因剪接變異體家族的短寡核苷酸序列來產生的,透過將該序列直接合成到陣列表面而不是沉積完整的序列。根據所需目的,序列可能更長 (60 聚體探針,如安捷倫設計的) 或更短 ( Affymetrix生產的 25 聚體探針);較長的探針對單一目標基因更具特異性,而較短的探針可以以更高的密度分佈在陣列上,並且製造成本更便宜。用於生產寡核苷酸陣列的一項技術包括在二氧化矽基底上進行光刻合成(Affymetrix),其中使用光和光敏掩蔽劑在整個陣列上一次一個核苷酸地「構建」一個序列。[ 14 ]在將陣列浸泡在單一核苷酸溶液中之前,每個適用的探針都會被選擇性地“揭露”,然後發生掩蓋反應,下一組探針會被揭露,以準備暴露不同的核苷酸。經過多次重複後,每個探針的序列都已完整建構。最近,NimbleGen Systems 的無掩模陣列合成將靈活性與大量探針結合在一起。[ 15 ]
雙通道與單通道偵測

雙色微陣列或雙通道微陣列通常與兩個要比較的樣本(例如患病組織與健康組織)製備的 cDNA雜交,並且以兩種不同的螢光團標記。[ 16 ] 常用於 cDNA 標記的螢光染料包括Cy 3,其螢光發射波長為 570 nm(對應光譜的綠色部分),以及Cy 5,其螢光發射波長為 670 nm(對應光譜的光譜中的紅色部分) 。將兩個 Cy 標記的 cDNA 樣本混合併雜交到單個微陣列中,然後放入微陣列掃描儀中進行掃描,以在用特定波長的雷射光束激發後可視化兩個螢光團的螢光。然後可以使用基於比率的分析來分析每個螢光團的相對強度來識別上調和下調的基因。[ 17 ]
寡核苷酸微陣列通常攜帶用於與RNA 插入物雜交的控制探針。使用插入探針和對照探針之間的雜交程度來標準化目標探針的雜交測量值。儘管在極少數情況下可以透過雙色陣列確定基因表現的絕對水平,但樣本內不同斑點之間以及樣本之間表達的相對差異是雙色系統資料分析的首選方法。此類微陣列的供應商包括擁有雙模式平台的安捷倫、擁有用於比色Silverquant標記的 DualChip 平台的Eppendorf以及擁有Arrayit的 TeleChem International 。
在單通道微陣列或單色微陣列中,陣列提供每個探針或探針組的強度數據,顯示與標記目標的雜交的相對水平。然而,它們並不能真正表明基因的豐度水平,而是與在同一實驗中處理的其他樣本或條件相比的相對豐度。每個 RNA 分子在實驗的擴增、標記和雜交階段都會遇到協議和批次特定的偏差,導致同一微陣列之間的基因比較無法提供資訊。同一基因的兩種情況的比較需要兩次單獨的單染料雜交。幾種流行的單通道系統是 Affymetrix「基因晶片」、Illumina「珠晶片」、Agilent 單通道陣列、Applied Microarrays「CodeLink」陣列和 Eppendorf「DualChip & Silverquant」。單染料系統的一個優點在於,異常樣本不會影響從其他樣本獲得的原始數據,因為每個陣列晶片只接觸一個樣本(與雙色系統相反,在雙色系統中,單個低-即使另一個樣本質量很高,品質樣本也可能嚴重影響整體資料精度。另一個好處是,只要考慮到批次效應,就可以更容易地將數據與來自不同實驗的陣列進行比較。
在某些情況下,單通道微陣列可能是唯一的選擇。認為需要比較樣本:那麼使用雙通道陣列所需的實驗數量很快就會變得不可行,除非使用樣本作為參考。
| 樣本數 | 單通道微陣列 | 雙通道微陣列 | 雙通道微陣列(含參考) |
|---|---|---|---|
| 1 | 1 | 1 | 1 |
| 2 | 2 | 1 | 1 |
| 3 | 3 | 3 | 2 |
| 4 | 4 | 6 | 3 |
典型協議
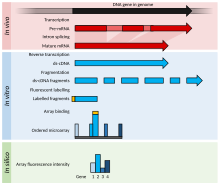
這是DNA 微陣列實驗的一個範例,其中包括特定案例的細節,以更好地解釋 DNA 微陣列實驗,同時列出 RNA 或其他替代實驗的修改。
- 兩個要比較(成對比較)的樣本是生長/獲得的。在此範例中,處理過的樣本(案例)和未處理的樣本(對照)。
- 純化感興趣的核酸:可以是用於表達譜分析的RNA、用於比較雜交的DNA ,或與特定蛋白質結合的 DNA/RNA,後者可以透過免疫沉澱(ChIP-on-chip)用於表觀遺傳或調控研究。在這個例子中,透過胍基硫氰酸鹽-苯酚-氯仿提取(例如Trizol)分離總RNA(核和細胞質) ,這分離了大多數RNA(而柱方法的截止值為200個核苷酸) ,並且如果操作正確則具有更好的純度。
- 對純化的 RNA 進行品質分析(透過毛細管電泳)和數量分析(例如,使用NanoDrop或 NanoPhotometer光譜儀)。如果材料品質可接受且數量足夠(例如,>1 μg,儘管所需的數量因微陣列平台而異),則實驗可以繼續。
- 標記產品經由逆轉錄生成,然後進行可選的PCR擴增。利用 polyT 引子(僅擴增mRNA)或隨機引子(擴增所有 RNA,其中大部分是rRNA )對 RNA 進行逆轉錄。miRNA微陣列將寡核苷酸連接到純化的小RNA(以分餾器分離),然後進行逆轉錄和擴增。
- 標籤可以在逆轉錄步驟期間添加,或在進行擴增之後添加。正義標記依賴微陣列;例如,如果標籤與 RT 混合物一起添加,則cDNA是反義的,而微陣列探針是有義的,陰性對照的情況除外。
- 該標籤通常是螢光的;只有一台機器使用放射性標記。
- 標記可以是直接的(不使用)或間接的(需要耦合階段)。對於雙通道陣列,偶聯階段發生在雜交之前,使用氨基烯丙基 尿苷 三磷酸(氨基烯丙基-UTP,或aaUTP)和NHS氨基反應性染料(如菁染料);對於單通道陣列,耦合階段發生在雜交之後,使用生物素和標記的鏈黴親和素。修飾的核苷酸(通常比例為 1 aaUTP:4 TTP(三磷酸胸苷))以低比例透過酵素添加到正常核苷酸中,通常每 60 個鹼基添加 1 個。然後用柱子純化 aaDNA (使用磷酸鹽緩衝溶液,因為Tris含有胺基)。氨基烯丙基是附著在核鹼基上的長連接體上的胺基,可與活性染料反應。
- 然後將標記的樣本與專有雜交溶液混合,該溶液可能由SDS、SSC、硫酸葡聚醣、阻斷劑(如Cot-1 DNA、鮭魚精子 DNA、小牛胸腺 DNA、PolyA或 PolyT)、Denhardt溶液組成,或福爾馬胺。
- 將混合物變性並添加到微陣列的針孔中。將孔密封並將微陣列雜交,可以在雜交爐中雜交,在雜交爐中透過旋轉混合微陣列,或在雜交爐中透過在針孔處交替施加壓力來混合微陣列。
- 經過過夜雜交後,所有非特異性結合都會被洗掉(SDS 和 SSC)。
- 微陣列被乾燥後,透過一台機器進行掃描,該機器使用雷射激發染料,並用探測器測量發射水平。
- 影像以模板網格化,並量化每個特徵(由幾個像素組成)的強度。
- 原始數據已標準化;最簡單的標準化方法是減去背景強度和尺度,使得兩個通道特徵的總強度相等,或使用參考基因的強度來計算所有強度的t 值。更複雜的方法包括z-ratio、loess 和 lowess 回歸和針對 Affymetrix 晶片(單通道、矽晶片、原位合成短寡核苷酸)的 RMA(穩健多晶片分析)。
微陣列和生物資訊學

廉價微陣列實驗的出現帶來了幾個具體的生物資訊挑戰:[ 19 ]實驗設計中的多層次複製(實驗設計);平台數量及獨立組別及資料格式(標準化);資料的統計處理(資料分析);將每個探針映射到它測量的mRNA轉錄本(註釋);大量的資料以及共享資料的能力(資料倉儲)。
實驗設計
由於基因表現的生物學複雜性,如果要從數據中得出統計學和生物學上有效的結論,表達譜文章中討論的實驗設計考慮至關重要。
設計微陣列實驗時需要考慮三個主要因素。首先,生物樣本的複製對於得出實驗結論至關重要。其次,技術重複(例如從每個實驗單元獲得的兩個 RNA 樣本)可能有助於量化精確度。生物學重複包括獨立的 RNA 萃取。技術重複可能是同一種萃取物的兩個等分試樣。第三,每個 cDNA 克隆或寡核苷酸的斑點在微陣列載玻片上以重複品(至少是重複品)的形式存在,以提供每次雜交的技術精度測量。討論樣品製備和處理的資訊至關重要,以幫助識別實驗中的獨立單元並避免對統計意義的估計過高。[ 20 ]
標準化
由於平台製造、偵測方案和分析方法缺乏標準化,微陣列資料難以交換。這帶來了生物資訊學中的互通性問題。各種草根開源專案正在嘗試簡化非專有晶片產生的資料的交換和分析:
例如,「關於微陣列實驗的最低限度資訊」(MIAME)清單有助於定義應有的詳細程度,並且被許多期刊採用作為提交包含微陣列結果的論文的要求。但是 MIAME 沒有描述資訊的格式,因此雖然許多格式可以支援 MIAME 要求,但截至 2007 年,沒有任何格式允許驗證完整的語義合規性。美國食品藥物管理局(FDA)正在進行“微陣列品質控制 (MAQC) 計畫”,旨在製定標準和品質控制指標,最終允許在藥物發現、臨床實踐和監管決策中使用微陣列數據。[ 21 ] MGED協會制定了基因表現實驗結果和相關註釋的表示標準。
數據分析

微陣列資料集通常非常大,並且分析精度受許多變數的影響。統計挑戰包括考慮背景噪音的影響和數據的適當規範化。標準化方法可能適合於特定平台,對於商業平台,分析可能是專有的。[ 22 ]影響統計分析的演算法包括:
- 影像分析:網格化、掃描影像的點識別(分割演算法)、去除或標記品質差和強度低的特徵(稱為標記)。
- 資料處理:背景減法(基於全局或局部背景)、確定點強度和強度比、資料視覺化(例如參見MA 圖)、比率的對數轉換、強度比的全局或局部標準化以及分割成使用步驟檢測演算法對不同拷貝數區域進行檢測。[ 23 ]
- 類別發現分析:這種分析方法有時稱為無監督分類或知識發現,試圖識別微陣列(物體、患者、小鼠等)或基因是否聚集在一起。識別自然存在的聚集在一起的物體群體(微陣列或基因)可以發現以前未知存在的新群體。在知識發現分析過程中,可以對 DNA 微陣列資料採用各種無監督分類技術來識別陣列的新簇(類別)。[ 24 ]這種方法不是由假設驅動的,而是基於迭代模式識別或統計學習方法來找到資料中的「最佳」聚類數量。無監督分析方法的例子包括自組織映射、神經氣體、K均值聚類分析、[ 25 ]層次聚類分析、基於基因組訊號處理的聚類和基於模型的聚類分析。對於其中一些方法,使用者還必須定義物件對之間的距離測量。雖然通常採用皮爾遜相關係數,但文獻中也提出並評估了其他幾種測量方法。[ 26 ]類別發現分析中使用的輸入資料通常基於具有高資訊量(低雜訊)的基因列表,這些基因列表基於低變異係數值或高香農熵值等。的最佳聚類數量稱為聚類有效性。一些常用的聚集效度指標包括輪廓指數、戴維斯-博爾丁指數、[ 27 ]鄧恩指數或休伯特指數統計。
- 類別預測分析:這種方法稱為監督分類,它為開發預測模型奠定了基礎,可以將未來未知的測試對象輸入到該預測模型中,以預測測試對象最可能的類別成員身份。用於類別預測的監督分析[ 24 ]涉及使用諸如線性迴歸、k最近鄰、學習向量量化、決策樹分析、隨機森林、樸素貝葉斯、邏輯迴歸、核迴歸、人工神經網路、支援向量機等技術,專家的混合,並監督神經氣體。此外,還採用了各種元啟發式方法,例如遺傳演算法、協方差矩陣自適應、粒子群最佳化和蟻群最佳化。類別預測的輸入資料通常基於可預測類別的基因的過濾列表,使用經典假設檢定(下一節)、基尼多樣性指數或資訊增益(熵)確定。
- 假設驅動的統計分析:通常使用t 檢定、變異數分析、貝葉斯方法識別基因表現的統計學顯著變化[ 28 ] 針對微陣列資料集定制的Mann-Whitney 檢定方法,其中考慮了多重比較[ 29 ]或聚類分析。[ 30 ]這些方法根據數據中存在的變化和實驗重複的次數來評估統計功效,並有助於最大限度地減少分析中的I 類錯誤和 II 類錯誤。 [ 31 ]
- 降維:分析師通常在分析資料之前減少維度(基因)的數量。[ 24 ]這可能涉及線性方法,例如主成分分析(PCA),或使用核PCA、擴散圖、拉普拉斯特徵圖、局部線性嵌入、局部保持投影和Sammon 映射的非線性流形學習(距離度量學習)。
- 以網路為基礎的方法:考慮基因網路的底層結構的統計方法,表示基因產物之間的關聯或因果交互作用或依賴關係。[ 32 ] 加權基因共表達網絡分析廣泛用於識別共表達模組和模組內樞紐基因。模組可能對應細胞類型或路徑。高度連接的模組內集線器最能代表各自的模組。
微陣列資料可能需要進一步處理,以降低資料的維數,從而有助於理解和更有針對性的分析。[ 33 ]其他方法可以分析由少量生物學或技術重複組成的數據;例如,局部匯集誤差(LPE)測試匯集具有相似表達水平的基因的標準差,以彌補複製不足。[ 34 ]
註解
探針和它預期檢測的mRNA之間的關係並不簡單。 [ 35 ]一些 mRNA 可能會與陣列中本應檢測另一個 mRNA 的探針發生交叉雜交。此外,mRNA 可能會經歷序列或分子特異性的擴增偏差。第三,設計用於檢測特定基因 mRNA 的探針可能依賴與該基因錯誤關聯的 基因組EST資訊。
資料倉儲
與其他類似的數據集相比,微陣列數據被發現更有用。與資料集相關的大量資料、專門的格式(例如MIAME)和管理工作需要專門的資料庫來儲存資料。已經創建了許多開源資料倉儲解決方案,例如InterMine和BioMart,其特定目的是整合不同的生物資料集並支援分析。
替代技術
大規模平行定序的進步促進了RNA-Seq技術的發展,該技術能夠透過全轉錄組散彈槍法來表徵和量化基因表現。[ 36 ] [ 37 ]與需要有參考基因組和轉錄組才能設計微陣列不同,RNA-Seq 也可以用於基因組尚未定序的新模式生物。[ 37 ]
詞彙表
- 陣列或幻燈片是空間排列在二維網格中的特徵的集合,按列和行排列。
- 區塊或子陣列:一組點,通常在一次列印中製作;幾個子數組/塊組成一個數組。
- 病例/對照:一種特別適合雙色陣列系統的實驗設計範例,其中選擇作為對照的條件(例如健康組織或狀態)與改變的條件(例如患病組織或狀態)進行比較。
- 通道:掃描器中記錄的單一螢光團的螢光輸出,甚至可以是紫外線。
- 染料翻轉或染料交換或螢光逆轉:用兩種染料對 DNA 目標進行相互標記,以解釋實驗中的染料偏差。
- 掃描儀:一種用於檢測和量化微陣列載玻片上斑點螢光強度的儀器,透過雷射選擇性地激發螢光團並用濾波器(光學) 光電倍增管系統測量螢光。
- 點或特徵:陣列玻片上的一小塊區域,其中包含皮摩爾特定 DNA 樣本。
- 其他相關用語請參閱:
參見
參考
- Taub,Floyd(1983)。 「實驗室方法:透過電腦影像處理分析的連續比較雜交可以識別和定量受調控的 RNA」。DNA。2 ( 4 ) : 309– 327 。PMID 6198132。
- Adomas A;海勒 G;奧爾森 A;奧斯本 J;卡爾森 M;納哈爾科娃 J;範齊爾 L;塞德羅夫 R;史丹利德 J;芬利 R; Asiegbu FO(2008)。 「受到腐生真菌、致病真菌或互利共生真菌攻擊後,赤松中轉錄本豐度的比較分析」。樹木生理學。28 ( 6 ) : 885– 897 。PMID 18381269。
- 波拉克(JR);秘魯首席部長;阿里扎德 AA;艾森 MB;帕加門斯基科夫 A;威廉斯中鋒;傑弗裡 SS;博斯坦 D;布朗 PO(1999)。“利用 cDNA 微陣列進行全基因組 DNA 拷貝數變化分析”。天然基因。23 ( 1 ) : 41–46。 PMID 10471496。S2CID 997032。
- Moran G;斯托克斯 C;特韋斯 S;胡貝 B;科爾曼 DC;沙利文 D (2004)。「使用白色念珠菌 DNA 微陣列進行的比較基因組學揭示了都柏林念珠菌中毒力相關基因的缺失和分歧」。微生物學。150 (Pt 10): 3363–3382 。 doi : 10.1099 / mic.0.27221-0 。高密度脂蛋白:2262/6097。PMID 15470115。
- Hacia JG;范建斌;萊德 O;金L;埃奇蒙 K;甘杜爾 G;梅耶 RA;孫B;謝 L;羅賓斯 CM;布羅迪 LC;王丹;蘭德 ES;利普舒茨 R;福多爾 SP;柯林斯 FS(1999 年)。 「使用高密度寡核苷酸陣列確定人類單核苷酸多態性的祖先等位基因」。天然基因。22 ( 2 ) : 164–167。 PMID 10369258。S2CID 41718227。
- Gagna,Claude E.;蘭伯特,W.克拉克(2009 年 5 月 1 日)。 「新型多鏈、替代、質粒和螺旋過渡 DNA 和 RNA 微陣列:對治療學的意義」。藥物基因體學。10(5):895–914。ISSN1744-8042。PMID19450135。
- Gagna,Claude E.;克拉克·蘭伯特,W.(2007 年 3 月 1 日)。 「細胞生物學、化學基因體學和化學蛋白質體學—在藥物發現中的應用」。關於 藥物 研發 的 專家 意見.2(3):381–401。ISSN1746-0441。PMID23484648。S2CID41959328。
- Mukherjee, Anirban; Vasquez,Karen M.(2011 年 8 月 1 日)。「三重技術在DNA損傷、DNA修復和誘變研究的應用」。生物化學。93 ( 8 ) : 1197– 1208 。ISSN 1638-6183。PMC 3545518。PMID 21501652。
- Rhodes, Daniela; Lipps,Hans J.(2015 年 10 月 15 日)。「G-四鏈體及其在生物學中的調節作用」。核酸研究。43 ( 18 ) : 8627– 8637 。ISSN 1362-4962。PMC 4605312。PMID 26350216。
- 拉希德, Awais;郝元峰;夏先春;汗,阿瓦伊斯;徐雲璧; Varshney,Rajeev K.;何中虎 (2017)。「作物育種晶片和基因分型平台:進展、挑戰和前景」(PDF)。分子植物。10(8)。中國科學院+中國植物生物學會+上海生物科學研究所( Elsevier ): 1047– 1064 。ISSN 1674-2052。PMID 28669791。S2CID 33780984。
- J Biochem Biophys Methods。 2000年3月16日;42(3):105-10。 DNA 列印:利用標準噴墨印表機將核酸轉移到固體支撐物上。 Goldmann T,Gonzalez JS。
- Lausted C;等(2004)。「POSaM:一種快速、靈活、開源的噴墨寡核苷酸合成器和微陣列儀」。基因組生物學。5 (8): R58。doi : 10.1186/gb-2004-5-8-r58。PMC 507883。PMID 15287980。
- Bammler T, Beyer RP;毒理基因體學研究聯盟成員;克爾,X;靜,LX;拉皮杜斯,S;拉薩列夫,DA;保爾斯,RS;李建林;菲利普斯,SO(2005)。 「標準化實驗室之間和跨平台的全球基因表現分析」。自然方法。2 ( 5 ) : 351–356 。 PMID 15846362。S2CID 195368323。
- Pease AC;索拉斯 D;沙利文 EJ;克羅寧 MT;福爾摩斯CP;福多爾 SP (1994)。“用於快速 DNA 序列分析的光生成寡核苷酸陣列”。PNAS。91 ( 11 ) : 5022– 5026 。doi : 10.1073/pnas.91.11.5022。PMC 43922。PMID 8197176。
- Nuwaysir EF;黃偉;阿爾伯特 TJ;辛格 J;努韋西爾 K;皮塔斯 A;里士滿 T;戈爾斯基 T;伯格 JP;巴林 J;麥考密克 M;諾頓 J;波洛克 T;薩姆沃爾特 T;屠夫 L;波特D;莫拉 M; C 廳;布拉特納 F;薩斯曼 MR;華萊士 RL;塞琳娜 F; Green RD(2002)。“利用無掩模光刻製作的寡核苷酸陣列進行基因表現分析”。基因組研究12 (11): 1749– 1755. doi : 10.1101/gr.362402。PMC 187555。PMID 12421762。
- Shalon D;史密斯 SJ;布朗 PO(1996)。「利用雙色螢光探針雜交分析複雜 DNA 樣本的 DNA 微陣列系統」。基因組研究6 ( 7 ) : 639– 645 。 PMID 8796352。
- 唐 T;弗朗索瓦 N;格拉蒂尼 A;阿吉爾 N;穆基耶利 MH;阿格貝克 L;德拉克洛瓦(2007 年)。「透過校正影像錯位,雙色微陣列實驗中的表現率評估得到顯著改善」。生物資訊學。23 (20): 2686– 2691。doi : 10.1093 / bioinformatics/btm399。PMID 17698492。
- 沙菲宜, 湯瑪斯;洛威,羅漢(2017)。「真核生物和原核生物的基因結構」。維基醫學雜誌。4(1)。原文連結:https: //doi.org/10.15347/wjm/2017.002 . ISSN 2002-4436。S2CID 35766676。
- Tinker, Anna V.;布西奧塔斯,亞歷克斯; Bowtell,David DL(2006)。“基因表現微陣列對於人類癌症研究的挑戰”。癌細胞。9 ( 5 ) : 333–339 。 ISSN 1535-6108。PMID 16697954。
- 邱吉爾,喬治亞州(2002 年)。“cDNA 微陣列實驗設計基礎” (PDF)。自然遺傳學。補充。32:490–5。 PMID 12454643。S2CID 15412245。原文存檔於 2005 年 5 月 8 日(PDF)。2013 年12 月 12 日檢索。
- NCTR 毒理學資訊中心 – MAQC 項目
- “Prosigna | Prosigna 演算法”。請造訪 prosigna.com 。檢索日期:2017 年6 月 22 日。
- 利特爾,馬薩諸塞州;瓊斯,NS(2011)。“分段常數訊號的廣義方法和解算器:第一部分” (PDF)。英國皇家學會學報A。467 ( 2135 ) : 3088–3114。 PMC 3191861。PMID 22003312。
- Peterson,Leif E.(2013 年)。 DNA 微陣列的分類分析。約翰威利父子公司。國際標準書號 978-0-470-17081-6。
- De Souto M 等人。 (2008)聚類癌症基因表現資料:一項比較研究,BMC 生物資訊學,9(497)。
- Jaskowiak, Pablo A;坎佩洛,里卡多 JGB;科斯塔,Ivan G(2014 年)。“關於基因表現資料聚類適當距離的選擇”。BMC 生物資訊學。15 (補充2):S2。doi : 10.1186/1471-2105-15-S2-S2。PMC 4072854。PMID 24564555。
- Bolshakova N, Azuaje F (2003) 基因組表達資料的聚類驗證技術,訊號處理,Vol. 83,第 825-833 頁。
- Ben Gal, I.;沙尼,A.;戈爾,A.;格勞,J.;阿爾維夫,S.; Shmilovici,A.;波施,S.; Grosse,I.(2005)。 「使用變階貝葉斯網路辨識轉錄因子結合位點」。生物資訊學。21 (11): 2657– 2666。doi : 10.1093 / bioinformatics/bti410。ISSN 1367-4803。PMID 15797905。
- Yuk Fai Leung 和 Duccio Cavalieri,《cDNA 微陣列資料分析基礎》。遺傳學趨勢第 19 卷第 11 期,2003 年 11 月。
- 一世公主; Maimon O.; Ben-Gal I.(2007 年)。“透過互資訊距離測量評估基因表現聚類”。BMC 生物資訊學。8 (1): 111. doi : 10.1186/1471-2105-8-111。PMC 1858704。PMID 17397530。
- 魏C;李傑; Bumgarner RE(2004 年)。“在微陣列實驗中檢測差異表達基因的樣本量”。BMC 基因組學。5 : 87.doi : 10.1186 /1471-2164-5-87。PMC 533874。PMID 15533245。
- Emmert-Streib,F. & Dehmer,M. (2008)。微陣列資料分析一種基於網路的方法。威利-VCH。國際標準書號 978-3-527-31822-3。
- Wouters L; Gõhlmann HW; Bijnens L;蘇卡斯莫倫伯格 G; Lewi PJ(2003 年)。 「基因表現資料的圖形探索:三種多元方法的比較研究」。生物辨識技術。59 ( 4 ) : 1131–1139 。 doi : 10.1111/j.0006-341X.2003.00130.x。PMID 14969494。S2CID 16248921。
- Jain N;塔特 J;支架 T;萊伊K;奧康奈爾 M;李建科(2003)。“使用少量複製的微陣列識別差異表達基因的局部匯集誤差檢定”。生物資訊學。19 (15) :1945–1951。doi : 10.1093 / bioinformatics/btg264。PMID 14555628。
- Barbosa-Morais, NL;鄧寧,MJ;南非薩馬拉吉瓦;達洛特,JFJ;里奇,緬因州;林奇,AG; Tavare,S.(2009 年 11 月 18 日)。“Illumina BeadArrays 的重新註釋流程:改進基因表現數據的解釋”。核酸研究。38 (3): e17。doi : 10.1093/nar/gkp942。PMC 2817484。PMID 19923232。
- 莫爾塔扎維, 阿里;布萊恩·A·威廉斯肯尼斯·麥庫伊洛里安·謝弗芭芭拉·沃爾德(Barbara Wold)(2008 年 7 月)。 「透過 RNA-Seq 繪製和量化哺乳動物轉錄組」。自然方法。5 ( 7 ) : 621– 628 。ISSN 1548-7091。PMID 18516045。S2CID 205418589。
- 王,鐘;馬克‧格斯坦;邁克爾·斯奈德(2009 年 1 月)。“RNA-Seq:轉錄組學的革命性工具”。天然遺傳學評論。10(1):57–63。ISSN1471-0056。PMC2949280。PMID19015660。
外部連結
- 微陣列動畫1Lec.com
- PLoS Biology 入門:微陣列分析
- 微陣列技術概述
- ArrayMining.net – 一個用於線上微陣列分析的免費網頁伺服器
- 微陣列-它是如何運作的?
- PNAS 評論:透過 DNA 微陣列資料的數學建模發現自然原理
- DNA微陣列虛擬實驗

| 系列文章的一部分 |
| 遺傳學 |
|---|
 |
去氧核糖核酸(/ d iː ˈ ɒ k s ɪ ˌ r aɪ b oʊ nj uː ˌ k l iː ɪ k , - ˌ k l eɪ -/ ⓘ; [ 1 ] 脫氧核糖核酸 ( DNA) 是核苷酸組成的聚合物,這兩條多核苷酸鏈相互纏繞,形成雙螺旋。這種聚合物攜帶著所有已知生物和許多病毒發育、功能、生長和繁殖的遺傳。 DNA和核糖核酸(RNA)都是核酸。與蛋白質、脂質和複合碳水化合物(多醣生命形式所必需的大分子類型之一。
兩條 DNA 鏈被稱為多核苷酸,因為它們由稱為核苷酸的更簡單的單體單元組成。[ 2 ] [ 3 ]每個核苷酸由四個含氮核鹼基(胞嘧啶[C]、鳥嘌呤[G]、腺嘌呤[A]或胸腺嘧啶[T])之一、一個稱為脫氧核糖的糖和一個磷酸基組成。核苷酸以鏈的形式透過共價鍵(稱為磷酸二酯鍵)相互連接,其中一個核苷酸的醣類和另一個核苷酸的磷酸之間形成交替的醣磷酸骨架。根據鹼基配對規則(A 與 T 以及 C 與 G),兩條獨立的多核苷酸鏈的含氮鹼基透過氫鍵結合在一起,形成雙股 DNA。互補的含氮鹼基分為兩類:單環嘧啶和雙環嘌呤。在 DNA 中,嘧啶是胸腺嘧啶和胞嘧啶;嘌呤是腺嘌呤和鳥嘌呤。
雙股 DNA 的兩條鏈都儲存相同的生物訊息。當兩條鏈分離時,這些資訊就會被複製。 DNA 的很大一部分(人類超過 98%)是非編碼的,這意味著這些部分不能作為蛋白質序列的模式。 DNA 的兩條鏈以相反的方向延伸,因此是反向平行的。每顆糖上附著有四種核鹼基(或鹼基)之一。正是這四個核鹼基沿著主鏈的序列編碼了遺傳訊息。 RNA 鏈是以 DNA 鏈為模板在轉錄過程中創建的,其中 DNA 鹼基被替換為其相應的鹼基,但胸腺嘧啶 (T) 除外,因為 RNA 會用尿嘧啶(U) 取代胸腺嘧啶(T )。[ 4 ]根據遺傳密碼,這些 RNA 鏈在翻譯過程中決定蛋白質內的胺基酸序列。
在真核細胞中,DNA被組織成稱為染色體的長結構。在典型的細胞分裂之前,這些染色體在 DNA 複製過程中被複製,為每個子細胞提供一套完整的染色體。真核生物(動物、植物、真菌和原生生物)的 DNA 大部分以核 DNA 的形式儲存在細胞核內,一部分以粒線體 DNA 的形式儲存在粒線體中,或以葉綠體 DNA 的形式儲存在葉綠體中。[ 5 ]相較之下,原核生物(細菌和古細菌)的 DNA 僅儲存在細胞質中的環狀染色體中。在真核生物的染色體中,染色質蛋白(如組蛋白)會壓縮和組織 DNA。這些壓縮結構引導 DNA 與其他蛋白質之間的相互作用,幫助控制 DNA 的哪些部分被轉錄。
特性

DNA 是一種由稱為核苷酸的重複單元構成的長聚合物。[ 6 ] [ 7 ] DNA 的結構沿其長度是動態的,能夠捲曲成緊密的環或其他形狀。[ 8 ]在所有物種中,它都是由兩條螺旋鏈組成,透過氫鍵相互結合。兩條鏈都繞同一軸盤繞,螺距均為34埃(3.4 奈米)。這對鏈的半徑為 10 Å (1.0 nm)。[ 9 ]另一項研究表明,在不同溶液中測量時,DNA鏈的寬度為22-26 Å(2.2-2.6奈米),一個核苷酸單元的長度為3.3 Å(0.33奈米)。[ 10 ]大多數DNA的浮力密度為1.7g/cm 3。[ 11 ]
DNA 通常不以單股形式存在,而是以緊密結合在一起的一對鏈形式存在。[ 9 ] [ 12 ]這兩條長鏈相互纏繞,形成雙螺旋結構。核苷酸既包含分子主鏈的片段(將鏈條連接在一起),也包含核鹼基(與螺旋中的另一條 DNA 鏈相互作用)。與糖相連的核鹼基稱為核苷,與糖和一個或多個磷酸基相連的鹼基稱為核苷酸。由多個連接在一起的核苷酸(如 DNA)組成的生物聚合物稱為多核苷酸。[ 13 ]
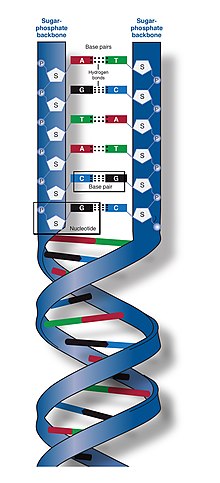
DNA鏈的主幹是由交替的磷酸基和糖基構成的。[ 14 ] DNA中的糖是2-脫氧核糖,它是一種戊糖(五碳)。糖透過磷酸基團連接,磷酸基團在相鄰糖環的第三和第五個碳原子之間形成磷酸二酯鍵。這些被稱為3′ 端(三個主要端)和5′ 端(五個主要端)碳,主要符號用於區分這些碳原子與脫氧核糖形成糖苷鍵的鹼基的碳原子。[ 12 ]
因此,任何 DNA 鏈通常有一端有一個磷酸基團,與核糖的 5′ 碳(5′磷酰基)相連,另一端有一個自由羥基,與核糖的 3′ 碳相連。 3′ 和 5′ 碳沿著糖磷酸骨架的方向賦予每條 DNA 鏈方向性(有時稱為極性)。在核酸雙螺旋結構中,一條鏈上的核苷酸方向與另一條鏈上的核苷酸方向相反:兩條鏈是反向平行的。據稱,DNA 鏈的不對稱末端具有五個主要末端(5′)和三個主要末端(3′)的方向性,其中 5′ 端具有末端磷酸基團,而 3′ 端具有末端羥基。 DNA 和RNA之間的一個主要區別是糖,DNA 中的 2-脫氧核糖被 RNA 中相關的戊糖核糖所取代。[ 12 ]
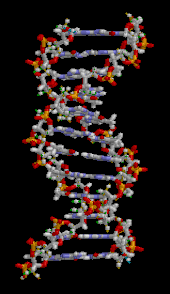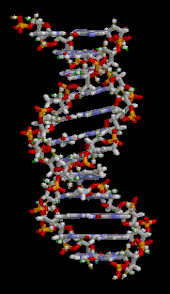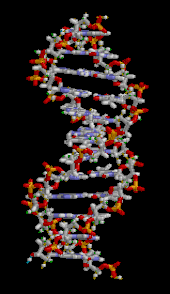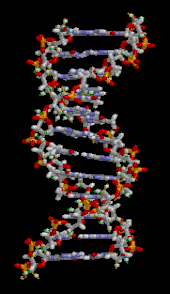
DNA雙螺旋主要由兩種力量來穩定:核苷酸之間的氫鍵和芳香核鹼基之間的鹼基堆積相互作用。[ 16 ] DNA 中發現的四種鹼基是腺嘌呤(A)、胞嘧啶(C)、鳥嘌呤(G)和胸腺嘧啶(T)。這四種鹼基與糖磷酸鹽結合,形成完整的核苷酸,如腺苷一磷酸所示。腺嘌呤與胸腺嘧啶配對,鳥嘌呤與胞嘧啶配對,形成AT和GC鹼基對。[ 17 ] [ 18 ]
核鹼基分類
核鹼基分為兩類:嘌呤(A和G),為稠合的五元和六元雜環化合物;嘧啶(C和T),為六元環。[ 12 ]第五種嘧啶鹼基尿嘧啶(U)通常取代RNA中的胸腺嘧啶,其與胸腺嘧啶的區別是尿嘧啶環上缺少甲基。除了RNA和DNA之外,人們還創造了許多人工核酸類似物,用於研究核酸的性質或用於生物技術。[ 19 ]
非規範基礎
DNA 中存在經過修飾的鹼基。第一個被辨識的鹼基是5-甲基胞嘧啶,它在1925年在結核分枝桿菌的基因組中發現。避免細菌中的限制性酵素。此酵素系統至少在一定程度上充當分子免疫系統,保護細菌免受病毒感染。[ 21 ]胞嘧啶和腺嘌呤是較常見的修飾 DNA 鹼基,它們的修飾在植物和動物基因表現的表觀遺傳控制中起著至關重要的作用。[ 22 ]
已知 DNA 中存在大量非規範鹼基。[ 23 ]大部分是對標準鹼基加尿嘧啶的修飾。
- 修飾腺嘌呤
- N6-氨基甲醯甲基腺嘌呤
- N6-甲基腺嘌呤
- 修飾鳥嘌呤
- 7-脫氮鳥嘌呤
- 7-甲基鳥嘌呤
- 修飾胞嘧啶
- N4-甲基胞嘧啶
- 5-羧基胞嘧啶
- 5-甲醯胞嘧啶
- 5-糖基羥甲基胞嘧啶
- 5-羥基胞嘧啶
- 5-甲基胞嘧啶
- 修飾胸苷
- α-麩醯胺酸
- α-腐胺胸腺嘧啶
- 尿嘧啶及其修飾
- 基地J
- 尿嘧啶
- 5-二羥基五尿嘧啶
- 5-羥甲基脫氧尿嘧啶
- 其他的
- 脫氧古嘌呤
- 2,6-二氨基嘌呤(2-氨基腺嘌呤)
凹槽

雙螺旋鏈構成 DNA 主鏈。我們可以在鏈之間的空間或凹槽中發現另一個雙螺旋。這些空隙與鹼基對相鄰,可能提供結合位點。由於股線彼此之間不是對稱分佈的,所以凹槽的尺寸也不相等。大溝寬 22 埃(2.2 奈米),小溝寬 12 埃(1.2 奈米)。[ 24 ]由於大溝的寬度較大,因此在大溝中比在小溝中更容易接觸到基部的邊緣。因此,能夠與雙股 DNA 中的特定序列結合的蛋白質(例如轉錄因子)通常會與大溝中暴露的鹼基側面接觸。 [ 25 ]這種情況在細胞內 DNA 的異常構像中有所變化(見下文) ,但大溝和小溝總是被命名,以反映如果 DNA 扭轉回普通的B 型,會看到的寬度差異。
鹼基配對
在 DNA 雙螺旋中,一條鏈上的每種核鹼基都與另一條鏈上的一種核鹼基結合。這稱為互補 鹼基配對。嘌呤與嘧啶形成氫鍵,腺嘌呤只與胸腺嘧啶以兩個氫鍵結合,胞嘧啶只與鳥嘌呤以三個氫鍵結合。這種兩個核苷酸透過雙螺旋(從六碳環到六碳環)結合在一起的排列稱為沃森-克里克鹼基對。GC 含量高的 DNA比GC含量低的 DNA 穩定。Hoogsteen 鹼基對(6 碳環與 5 碳環透過氫鍵結合)是鹼基配對的罕見變體。[ 26 ]由於氫鍵不是共價鍵,因此它們可以相對容易地斷裂和重新連接。因此,雙螺旋結構中的兩條 DNA 鏈可以像拉鍊一樣被拉開,無論是透過機械力還是高溫。[ 27 ]由於這種鹼基對互補性,DNA螺旋雙股序列中的所有資訊都會在每條鏈上複製,這對於 DNA 複製至關重要。互補鹼基對之間的這種可逆且特定的相互作用對於生物體中 DNA 的所有功能都至關重要。[ 7 ]
單股DNA與雙股DNA
大多數 DNA 分子實際上是兩條聚合物鏈,透過非共價鍵以螺旋方式結合在一起;這種雙股(dsDNA)結構主要由鏈內鹼基堆積作用維持,其中G、C堆積作用最強。兩條鏈可以分開(這個過程稱為熔化),形成兩條單股 DNA(ssDNA)分子。在高溫、低鹽和高pH下會發生熔化(低 pH 也會熔化 DNA,但由於 DNA 在酸性脫嘌呤後不穩定,因此很少使用低 pH)。
dsDNA 形式的穩定性不僅取決於GC含量(% G、C鹼基對),還取決於序列(因為堆疊是序列特定的)和長度(較長的分子更穩定)。穩定性可以透過多種方式來衡量;常見的方式是熔化溫度(也叫T m值),它是50%的雙鏈分子轉變為單鏈分子時的溫度;熔化溫度取決於離子強度和 DNA 濃度。因此,GC鹼基對的百分比和 DNA 雙螺旋的總長度決定了兩條 DNA 鏈之間結合的強度。具有高GC含量的長 DNA 螺旋具有更強的相互作用鏈,而具有高AT含量的短螺旋則具有更多較弱的相互作用鏈。[ 28 ]在生物學中,DNA雙螺旋結構中需要容易分離的部分,例如某些啟動子中的TATAAT Pribnow盒,往往具有較高的AT含量,這使得鏈更容易拉開。[ 29 ]
在實驗室中,可以透過找到打破一半氫鍵所需的熔化溫度T m來測量這種相互作用的強度。當 DNA 雙螺旋結構中的所有鹼基對熔化時,各鏈就會分離,並作為兩個完全獨立的分子存在於溶液中。這些單股 DNA 分子沒有單一的共同形狀,但有些構像比其他構象更穩定。[ 30 ]
數量

在人類中,每個細胞的女性二倍體 核基因組總長度為 6.37 千兆鹼基對 (Gbp),長 208.23 厘米,重 6.51 皮克 (pg)。[ 31 ]雄性值為 6.27 Gbp、205.00 公分、6.41 頁。[ 31 ]每個DNA聚合物可含有數億個核苷酸,例如1號染色體。 1號染色體是人類最大的染色體,約有2.2億個鹼基對,拉直後長為85毫米。[ 32 ]
在真核生物中,除了核DNA之外,還有粒線體DNA(mtDNA),它編碼粒線體使用的某些蛋白質。與核 DNA 相比,粒線體 DNA 通常相對較小。例如,人類粒線體DNA形成閉合的環狀分子,每個分子含有16,569個[ 33 ] [ 34 ] DNA鹼基對,[ 35 ]每個這樣的分子通常包含全套粒線體基因。每個人類粒線體平均含有大約 5 個這樣的 mtDNA 分子。[ 35 ]每個人類細胞含有大約 100 個粒線體,因此每個人類細胞的粒線體 DNA 分子總數約為500個。 100,000 個粒線體,對應多達1,500,000個粒線體基因組拷貝(佔細胞DNA的90%)。[ 36 ]
正義與反義
如果DNA 序列與翻譯成蛋白質的信使 RNA副本相同,則該DNA 序列稱為「正義」序列。 [ 37 ]相反鏈上的序列稱為「反義」序列。正義序列和反義序列可以存在於同一 DNA 鏈的不同部分(即兩條鏈可以同時包含正義序列和反義序列)。在原核生物和真核生物中,都會產生反義RNA序列,但這些RNA的功能尚不完全清楚。[ 38 ]有一種觀點認為,反義RNA透過RNA-RNA鹼基配對參與調控基因表現。 [ 39 ]
原核生物和真核生物中的一些DNA序列以及質粒和病毒中的更多DNA序列由於具有重疊基因而模糊了正鍊和反鏈之間的區別。[ 40 ]在這些情況下,有些DNA序列具有雙重功能,沿著一條鏈讀取時會編碼一種蛋白質,沿著另一條鏈以相反方向讀取時會編碼第二種蛋白質。在細菌中,這種重疊可能參與基因轉錄的調控,[ 41 ]而在病毒中,重疊基因增加了小病毒基因組內可編碼的資訊量。[ 42 ]
超螺旋
DNA 可以像繩子一樣扭曲,這個過程稱為DNA 超螺旋。當 DNA 處於「放鬆」狀態時,一條鏈通常每 10.4 個鹼基對繞雙螺旋軸旋轉一次,但如果 DNA 發生扭曲,鏈就會纏繞得更緊或更鬆散。[ 43 ]如果DNA沿著螺旋方向扭曲,這就是正超螺旋,鹼基之間的結合會更緊密。如果它們朝相反的方向扭曲,這就是負超螺旋,鹼基更容易分開。在自然界中,大多數DNA都具有輕微的負超螺旋,這是由稱為拓樸異構酶的酵素引入的。[ 44 ]這些酵素也需要緩解轉錄和DNA 複製等過程中引入 DNA 鏈的扭曲應力。[ 45 ]
替代 DNA 結構

DNA 存在多種可能的構象,包括A-DNA、B-DNA和Z-DNA形式,儘管在功能生物體中僅直接觀察到 B-DNA 和 Z-DNA。[ 14 ] DNA的構形取決於水合程度、DNA序列、超螺旋的數量和方向、鹼基的化學修飾、金屬離子的類型和濃度以及溶液中多胺的存在。[ 46 ]
首次發表的 A-DNA(以及 B-DNA) X 射線衍射圖案報告使用了基於帕特森函數的分析,該分析僅提供了 DNA 定向纖維的有限結構資訊。[ 47 ] [ 48 ] Wilkins等人提出了另一種分析方法。 1953 年,他以貝塞爾函數平方的形式對體內B-DNA 進行了 X 射線衍射散射實驗,實驗中採用了高度水合的 DNA 纖維。[ 49 ]在同一期刊上,詹姆斯·沃森和弗朗西斯·克里克發表了他們對 DNA X 射線衍射圖的分子建模分析,表明該結構為雙螺旋結構。[ 9 ]
儘管B-DNA形式在細胞中發現的條件下最為常見,[ 50 ] 但它並不是一種明確界定的構象,而是一類相關的DNA構象[ 51 ],出現在細胞中高水合水平下。它們對應的X射線衍射和散射圖案是具有相當高無序程度的分子準晶體的特徵。 [ 52 ] [ 53 ]
與 B-DNA 相比,A-DNA 形式為更寬的右旋螺旋,具有淺而寬的小溝和更窄、更深的大溝。 A 形式在非生理條件下出現在部分脫水的 DNA 樣本中,而在細胞中,它可能在 DNA 和 RNA 鏈的混合配對中以及酶-DNA 複合物中產生。[ 54 ] [ 55 ]鹼基被甲基化化學修飾的 DNA 片段可能會發生較大的構象變化,並形成Z 型。在這裡,鏈圍繞螺旋軸以左旋螺旋方式旋轉,與更常見的 B 形式相反。[ 56 ]這些不尋常的結構可以被特定的Z-DNA結合蛋白識別,並可能參與轉錄調控。[ 57 ]
替代DNA化學
多年來,外星生物學家一直提出影子生物圈的存在,這是一種假設的地球微生物生物圈,其採用的生化和分子過程與目前已知的生命截然不同。其中一項提議是,存在使用DNA 中的砷而不是磷的生命形式。 2010 年的一份報告稱,細菌 GFAJ-1中存在這種可能性, [ 58 ] [ 59 ]儘管這項研究存在爭議,[ 59 ] [ 60 ]有證據表明,這種細菌能夠積極阻止砷融入DNA 骨架,並且其他生物分子。[ 61 ]
四鏈體結構

在線狀染色體的末端是 DNA 的特殊區域,稱為端粒。這些區域的主要功能是允許細胞使用端粒酶複製染色體末端,因為通常複製 DNA 的酶無法複製染色體的最末端 3′。[ 63 ]這些特殊的染色體帽也有助於保護 DNA 末端,並阻止細胞中的DNA 修復系統將它們視為需要修復的損傷。 [ 64 ]在人類細胞中,端粒通常為單股DNA長度,包含數千個簡單TTAGGG序列的重複序列。[ 65 ]
這些富含鳥嘌呤的序列可能透過形成四鹼基單元堆疊的結構來穩定染色體末端,而不是其他 DNA 分子中常見的鹼基對。這裡,四個鳥嘌呤鹼基(稱為鳥嘌呤四聯體)形成一個平板。這些扁平的四鹼基單元隨後堆疊在一起,形成穩定的G-四鏈體結構。[ 66 ]這些結構透過鹼基邊緣之間的氫鍵和每個四鹼基單位中心的金屬離子螯合來穩定。 [ 67 ]還可以形成其他結構,其中中心組的四個鹼基要麼來自折疊在鹼基周圍的單鏈,要麼來自幾條不同的平行鏈,每條鏈為中心結構貢獻一個鹼基。
除了這些堆疊結構之外,端粒還形成稱為端粒環或 T 環的大型環狀結構。在這裡,單股 DNA 捲曲成一個長圈,由端粒結合蛋白穩定下來。[ 68 ]在T環的末端,單股端粒DNA被端粒鏈固定在雙股DNA的區域上,從而破壞了雙螺旋DNA與兩條鏈中的一條鏈的鹼基配對。這種三鏈結構稱為置換環或D 環。[ 66 ]
分支DNA
 |  |
| 單一分支 | 多個分支 |
在 DNA 中,當互補的 DNA 雙股末端存在非互補區域時,就會發生磨損。然而,如果引入第三條 DNA 鏈,且該第三條 DNA 鏈包含能夠與現有雙股的磨損區域雜交的相鄰區域,則會出現分支 DNA。儘管最簡單的分支 DNA 例子僅涉及三個 DNA 鏈,但涉及更多鍊和多個分支的複合物也是可能的。[ 69 ]分支DNA可用於奈米技術,建構幾何形狀,請參閱下面有關技術應用的部分。
人工鹼基
已經合成了幾種人工核鹼基,並成功整合到名為「八文字 DNA」的八鹼基 DNA 類似物中。這些人工鹼基被稱為 S、B、P 和 Z,能夠以可預測的方式(S-B 和 P-Z)相互結合,維持 DNA 的雙螺旋結構,並轉錄為 RNA。它們的存在可以顯示地球上進化出的四種天然核鹼基並沒有什麼特殊之處。[ 70 ] [ 71 ]另一方面,DNA與RNA緊密相關,RNA不僅充當DNA的轉錄本,而且還作為分子機器在細胞中執行許多任務。為了達到這個目的,它必須折疊成一個結構。已經證明,為了創造所有可能的結構,相應的RNA至少需要四個鹼基,[ 72 ]雖然更多數量也是可能的,但這違背了最省力的自然原則。
酸度
DNA 的磷酸基使其具有與磷酸相似的酸性,可被視為強酸。它將在正常細胞 pH 值下完全電離,釋放出質子,並在磷酸基團上留下負電荷。這些負電荷可以排斥可能水解DNA 的親核試劑,從而保護 DNA 免於水解分解。[ 73 ]
宏觀外觀

從細胞中提取的純 DNA 形成白色、絲狀的團塊。[ 74 ]
化學修飾與 DNA 包裝改變
鹼基修飾與 DNA 包裝
基因的表達受到 DNA 在染色體中的包裝方式(即染色質的結構)的影響。鹼基修飾可能參與包裝,基因表現低或沒有基因表現的區域通常含有高水平的胞嘧啶鹼基甲基化。 DNA 包裝及其對基因表現的影響也可以透過對染色質結構中 DNA 包裹的組蛋白核心的共價修飾或透過染色質重塑複合物進行的重塑來實現(參見染色質重塑)。此外,DNA甲基化和組蛋白修飾之間存在串擾,因此它們可以協調影響染色質和基因表現。[ 75 ]
例如,胞嘧啶甲基化產生5-甲基胞嘧啶,這對於X 染色體的失活很重要。[ 76 ]不同生物體的甲基化平均值有差異-秀麗隱桿線蟲缺乏胞嘧啶甲基化,而脊椎動物的胞嘧啶甲基化水準較高,其DNA 中高達1% 含有5-甲基胞嘧啶。[ 77 ]儘管 5-甲基胞嘧啶非常重要,但它可以脫氨基並留下胸腺嘧啶鹼基,因此甲基化的胞嘧啶特別容易發生突變。[ 78 ]其他鹼基修飾包括細菌中的腺嘌呤甲基化,腦中5-羥甲基胞嘧啶的存在[ 79 ],以及動質體中尿嘧啶的糖基化產生“J-鹼基” 。[ 80 ] [ 81 ]
損害

DNA 能夠被多種誘變劑損傷,改變DNA 序列。誘變劑包括氧化劑、烷化劑以及高能量電磁輻射,如紫外線和X射線。產生的 DNA 損傷類型取決於誘變劑的類型。例如,紫外線可以透過產生胸腺嘧啶二聚體(嘧啶鹼基之間的交聯)來損傷 DNA。[ 83 ]另一方面,自由基或過氧化氫等氧化劑會產生多種形式的損傷,包括鹼基修飾(特別是鳥苷的修飾)和雙股斷裂。[ 84 ]一個典型的人類細胞中大約有 150,000 個鹼基遭受了氧化損傷。[ 85 ]在這些氧化損傷中,最危險的是雙股斷裂,因為這些損傷很難修復,而且能產生點突變、插入、DNA序列缺失以及染色體易位。[ 86 ]這些突變可能導致癌症。由於DNA修復機制固有的局限性,如果人類壽命夠長,他們最終都會罹患癌症。[ 87 ] [ 88 ]由於細胞正常過程產生活性氧、細胞水的水解活動等,自然發生的DNA損傷也常發生。儘管大多數損傷都得到了修復,但任何細胞中仍可能存在一些 DNA 損傷,儘管修復過程已經起作用。這些殘留的 DNA 損傷會隨著年齡的增長在哺乳動物有絲分裂後組織中累積。這種累積似乎是老化的一個重要潛在原因。[ 89 ] [ 90 ] [ 91 ]
許多誘變劑可以進入兩個相鄰鹼基對之間的空間,稱為插入。大多數插入劑是芳香族和平面分子;例子包括溴化乙錠,吖啶,柔紅黴素和阿黴素。為了使嵌入劑能夠插入鹼基對之間,鹼基之間必須分離,並透過解開雙螺旋來扭曲 DNA 鏈。這會抑制轉錄和 DNA 複製,導致毒性和突變。[ 92 ]因此,DNA插入劑可能是致癌物,而沙利度胺則是致畸劑。[ 93 ]其他物質如苯並[ a ]芘二醇環氧化物和黃麴毒素會形成DNA加合物,導致複製錯誤。[ 94 ]儘管如此,由於其具有抑制DNA轉錄和複製的能力,其他類似的毒素也用於化療,以抑制快速生長的癌細胞。[ 95 ]
生物功能

DNA在真核生物中通常以線狀染色體存在,在原核生物中則以環狀染色體存在。細胞中的染色體組構成其基因組;人類基因組約有 30 億個 DNA 鹼基對,排列在 46 條染色體上。[ 96 ] DNA 所攜帶的訊息保存在稱為基因的 DNA 片段序列中。基因中的遺傳訊息的傳遞是透過互補鹼基配對來實現的。例如,在轉錄中,當細胞使用基因中的信息時,DNA序列會透過DNA和正確的RNA核苷酸之間的吸引力而複製成互補的RNA序列。通常,該 RNA 拷貝隨後會用於在稱為翻譯的過程中製作匹配的蛋白質序列,該過程依賴 RNA 核苷酸之間的相同相互作用。換句話說,細胞可以透過一種稱為DNA 複製的過程複製其遺傳訊息。這些功能的詳細資訊在其他文章中介紹;這裡的重點是DNA與介導基因組功能的其他分子之間的相互作用。
基因和基因組
基因組 DNA 在DNA 凝聚的過程中緊密而有序地排列,以適應細胞的小可用體積。在真核生物中,DNA位於細胞核中,少量位於粒線體和葉綠體。在原核生物中,DNA 位於細胞質中一個形狀不規則的物體內,稱為類核。[ 97 ]基因組中的遺傳訊息保存在基因內,生物體中這些訊息的完整集合稱為其基因型。基因是遺傳單位,是影響生物體特定特徵的 DNA 區域。基因含有可轉錄的開放閱讀框,以及控制開放閱讀框轉錄的 調控序列,例如啟動子和增強子。
在許多物種中,基因組總序列中只有一小部分編碼蛋白質。例如,人類基因組中只有大約1.5%由蛋白質編碼外顯子組成,而超過50%的人類DNA由非編碼重複序列組成。[ 98 ]真核生物基因組中存在如此多非編碼DNA的原因,以及物種間基因組大小(或C值)的巨大差異,是一個長期存在的謎題,被稱為「C值之謎」。[ 99 ]然而,一些不編碼蛋白質的DNA序列仍可能編碼功能性的非編碼RNA分子,這些分子參與基因表現的調控。[ 100 ]

一些非編碼 DNA 序列在染色體中起著結構作用。端粒和著絲粒通常含有少量基因,但對染色體的功能和穩定性很重要。[ 64 ] [ 102 ]人類中大量存在的一種非編碼DNA形式是假基因,它們是因突變而喪失功能基因的拷貝。[ 103 ]這些序列通常只是分子化石,儘管它們偶爾也可以作為原始遺傳材料,透過基因複製和分化的過程產生新的基因。[ 104 ]
轉錄和翻譯
基因是包含遺傳訊息並能影響生物體表型的 DNA 序列。在基因內,DNA 鏈上的鹼基序列定義了信使 RNA序列,進而定義了一個或多個蛋白質序列。基因的核苷酸序列和蛋白質的胺基酸序列之間的關係由翻譯規則決定,統稱為遺傳密碼。遺傳密碼由三個字母的「單字」組成,這些單字稱為密碼子,由三個核苷酸序列組成(例如 ACT、CAG、TTT)。
在轉錄過程中,基因的密碼子被RNA聚合酶複製到信使RNA 。然後,核醣體解碼該 RNA 拷貝,核醣體透過將信使 RNA 與攜帶胺基酸的轉移 RNA進行鹼基配對來讀取 RNA 序列。由於 3 個字母的組合有 4 種鹼基,因此共有 64 種可能的密碼子(4+ 3 種 組合)。它們對二十種標準胺基酸進行編碼,使得大多數胺基酸有多個可能的密碼子。還有三個「終止」或「無義」密碼子,表示編碼區的結束;這些是 TAG、TAA 和 TGA 密碼子(mRNA 上的 UAG、UAA 和 UGA)。
複製

細胞分裂對於生物體的生長至關重要,但是,當細胞分裂時,它必須複製其基因組中的 DNA,以便兩個子細胞具有與其親本相同的遺傳訊息。 DNA的雙股結構為DNA複製提供了一個簡單的機制。在這裡,兩條鏈被分離,然後每條鏈的互補 DNA序列由一種稱為DNA 聚合酶的酶重新創建。這種酵素透過互補鹼基配對找到正確的鹼基並將其結合到原始鏈上,從而形成互補鏈。由於 DNA 聚合酶只能沿著 5′ 到 3′ 方向延伸 DNA 鏈,因此使用不同的機制來複製雙螺旋的反向平行鏈。[ 105 ]透過這種方式,舊鏈上的鹼基決定了新鏈上會出現哪個鹼基,最終細胞就得到了其 DNA 的完美副本。
細胞外核酸
裸露的細胞外DNA(eDNA)大部分是由細胞死亡而釋放的,在環境中幾乎無所不在。其在土壤中的濃度可能高達2μg/L,在天然水環境中的濃度可能高達88μg/L。[ 106 ]人們提出了eDNA的各種可能功能:它可能參與基因層次轉移;[ 107 ]它可能提供營養;[ 108 ]它也可以作為緩衝液來招募或滴定離子或抗生素。[ 109 ]細胞外DNA在幾種細菌的生物膜中充當功能性細胞外基質成分。它可能充當識別因子,調節生物膜中特定細胞類型的附著和分散;[ 110 ]可能有助於生物膜的形成;[ 111 ]它可能有助於提高生物膜的物理強度和抵抗生物壓力的能力。[ 112 ]
無細胞胎兒DNA存在於母親的血液中,可以對其進行定序以確定大量有關發育中胎兒的資訊。[ 113 ]
以環境 DNA為名的eDNA 在自然科學中得到越來越廣泛的應用,成為一種生態學調查工具,用於監測水、空氣或陸地上物種的運動和存在,以及評估一個地區的生物多樣性。[ 114 ] [ 115 ]
嗜中性球胞外陷阱
嗜中性球胞外陷阱(NET)是細胞外纖維網絡,主要由 DNA 組成,它允許嗜中性球(一種白血球)殺死細胞外病原體,同時最大限度地減少對宿主細胞的損害。
與蛋白質的相互作用
DNA的所有功能都依賴與蛋白質的相互作用。這些蛋白質相互作用可以是非特異性的,或者蛋白質可以特異性地結合單一 DNA 序列。酵素也可以與 DNA 結合,其中,在轉錄和 DNA 複製中複製 DNA 鹼基序列的聚合酶尤其重要。
DNA結合蛋白

結合 DNA 的結構蛋白是非特異性 DNA-蛋白質相互作用的眾所周知的例子。在染色體內,DNA 與結構蛋白複合在一起。這些蛋白質將 DNA 組織成稱為染色質的緊密結構。在真核生物中,這種結構涉及 DNA 與稱為組蛋白的小鹼性蛋白質複合物的結合,而在原核生物中則涉及多種類型的蛋白質。[ 116 ] [ 117 ]組蛋白形成一種盤狀複合體,稱為核小體,其表面纏繞著兩圈完整的雙股DNA。這些非特異性相互作用是透過組蛋白中的鹼性殘基形成的,與 DNA 的酸性糖磷酸骨架形成離子鍵,因此很大程度上與鹼基序列無關。[ 118 ]這些鹼性胺基酸殘基的化學修飾包括甲基化、磷酸化和乙醯化。[ 119 ]這些化學變化改變了 DNA 和組蛋白之間相互作用的強度,使得 DNA 更容易或更難與轉錄因子接觸,從而改變轉錄速率。[ 120 ]染色質中的其他非特異性DNA結合蛋白包括高遷移率族蛋白,它們能與彎曲或扭曲的DNA結合。[ 121 ]這些蛋白質對於彎曲核小體陣列並將它們排列成構成染色體的更大結構非常重要。[ 122 ]
一類獨特的 DNA 結合蛋白是特異性結合單股 DNA 的 DNA 結合蛋白。在人類中,複製蛋白 A是該家族中最了解的成員,用於雙螺旋分離的過程,包括 DNA 複製、重組和 DNA 修復。[ 123 ]這些結合蛋白似乎可以穩定單股DNA,並保護其不形成莖環或被核酸酶降解。

相反,其他蛋白質已經進化到可以與特定的 DNA 序列結合。其中研究最深入的是各種轉錄因子,它們是調節轉錄的蛋白質。每個轉錄因子都與一組特定的 DNA 序列結合,並活化或抑制這些序列靠近啟動子的基因的轉錄。轉錄因子透過兩種方式實現這一點。首先,它們可以直接或透過其他介導蛋白結合負責轉錄的RNA聚合酶;這將聚合酶定位於啟動子處並使其開始轉錄。[ 125 ]或者,轉錄因子可以結合修飾啟動子處組蛋白的酵素。這改變了 DNA 模板對聚合酶的可及性。[ 126 ]
由於這些 DNA 標靶可以出現在整個生物體的基因組中,因此一種轉錄因子活性的變化可能會影響數千個基因。[ 127 ]因此,這些蛋白質通常是控制對環境變化或細胞分化和發育的反應的訊號傳導過程的目標。這些轉錄因子與 DNA 相互作用的特異性來自於蛋白質與 DNA 鹼基邊緣的多次接觸,使它們能夠「讀取」DNA 序列。大多數鹼基相互作用發生在大溝中,因為鹼基在這裡最容易接觸。[ 25 ]
DNA修飾酶
核酸酶和連接酶

核酸酶是透過催化磷酸二酯鍵水解來切割 DNA 鏈的酵素。從 DNA 鏈末端水解核苷酸的核酸酶稱為外切核酸酶,而內切核酸酶則在鏈內切割。分子生物學中最常用的核酸酶是限制性內切酶,它可以在特定序列處切割 DNA。例如,左側所示的 EcoRV 酶可識別 6 鹼基序列 5′-GATATC-3′ 並在水平線處切割。在自然界中,這些酵素作為限制修飾系統的一部分,在噬菌體DNA進入細菌細胞時消化噬菌體DNA,從而保護細菌免受噬菌體的感染。[ 129 ]在技術上,這些序列特異性核酸酶用於分子克隆和DNA 指紋辨識。
一種稱為DNA 連接酶的酵素可以將切斷或斷裂的 DNA 鏈重新連接起來。[ 130 ]連接酶在滯後鏈DNA 複製中特別重要,因為它們將複製叉產生的短片段 DNA 連接成完整的 DNA 模板副本。它們也用於DNA修復和基因重組。[ 130 ]
拓樸異構酶和解旋酶
拓樸異構酶是具有核酸酶和連接酶活性的酵素。這些蛋白質改變了DNA中超螺旋的數量。一些酶透過切割 DNA 螺旋並允許其中一個部分旋轉來發揮作用,從而降低其超螺旋水平;然後酵素就封閉了DNA斷裂處。[ 44 ]其他類型的酵素能夠切割一個DNA螺旋,然後讓第二條DNA鏈穿過這個斷裂處,最後重新加入螺旋。[ 131 ]許多涉及DNA的過程都需要拓樸異構酶,例如DNA複製和轉錄。[ 45 ]
解旋酶是一種分子馬達蛋白質。它們利用三磷酸核苷(主要是三磷酸腺苷(ATP))中的化學能,打破鹼基之間的氫鍵,將 DNA 雙螺旋解開為單股。[ 132 ]這些酵素對於大多數需要酵素接觸 DNA 鹼基的過程至關重要。
聚合酶
聚合酶是由三磷酸核苷合成多核苷酸鏈的酵素。其產品序列是根據現有的多核苷酸鏈(稱為模板)創建的。這些酵素透過反覆將核苷酸添加到生長的多核苷酸鏈末端的3'羥基上來發揮作用。因此,所有聚合酶都以 5′ 到 3′ 的方向運作。[ 133 ]在這些酵素的活性位點,進入的核苷三磷酸與模板形成鹼基配對:這使得聚合酶能夠準確地合成其模板的互補鏈。聚合酶根據其使用的模板類型進行分類。
在 DNA 複製中,DNA 依賴性DNA 聚合酶會複製 DNA 多核苷酸鏈。為了保存生物訊息,每個副本中的鹼基序列必須與模板鏈中的鹼基序列精確互補。許多 DNA 聚合酶具有校對活性。在這裡,聚合酶透過錯配的核苷酸之間缺乏鹼基配對來識別合成反應中偶爾出現的錯誤。如果檢測到錯配,則會活化 3′ 到 5′外切酶活性並去除錯誤的鹼基。[ 134 ]在大多數生物體中,DNA聚合酶在一個稱為複製體的大型複合體中發揮作用,該複合體含有多個附屬亞基,如DNA鉗或解旋酶。[ 135 ]
RNA依賴性DNA聚合酶是一類特殊的聚合酶,可將RNA鏈的序列複製到DNA中。它們包括逆轉錄酶(一種參與逆轉錄病毒感染細胞的病毒酶)和端粒酶(端粒複製所必需的)。[ 63 ] [ 136 ]例如,HIV逆轉錄酶是愛滋病毒複製的一種酵素。[ 136 ]端粒酶是一種不尋常的聚合酶,因為它的結構中包含自己的 RNA 模板。它在染色體末端合成端粒。端粒可防止相鄰染色體末端融合併保護染色體末端免受損傷。[ 64 ]
轉錄由 DNA 依賴性RNA 聚合酶進行,該聚合酶將 DNA 鏈的序列複製到 RNA 中。為了開始轉錄基因,RNA 聚合酶會與稱為啟動子的 DNA 序列結合並分離 DNA 鏈。然後,它將基因序列複製到信使 RNA轉錄本中,直到到達稱為終止子的 DNA 區域,在此停止並從 DNA 上分離。與人類 DNA 依賴性 DNA 聚合酶一樣,RNA 聚合酶 II(轉錄人類基因組中大多數基因的酶)作為具有多個調節和附屬亞基的大型蛋白質複合物的一部分發揮作用。 [ 137 ]
基因重組
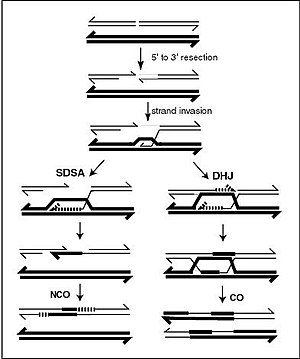
DNA螺旋通常不會與其他DNA片段相互作用,並且在人類細胞中,不同的染色體甚至佔據細胞核中稱為「染色體區域」的不同區域。[ 139 ]不同染色體之間的物理分離對於 DNA 作為穩定的資訊儲存庫的功能至關重要,因為染色體相互作用的少數幾次之一就是在有性生殖過程中發生的染色體交叉,此時會發生基因重組。染色體交叉是指兩個 DNA 螺旋斷裂、交換一部分然後重新連接。
重組使染色體能夠交換遺傳訊息並產生新的基因組合,從而提高了自然選擇的效率,並且對於新蛋白質的快速進化至關重要。[ 140 ]基因重組也可能參與 DNA 修復,特別是在細胞對雙股斷裂的反應。[ 141 ]
染色體交叉最常見的形式是同源重組,其中所涉及的兩個染色體具有非常相似的序列。非同源重組會對細胞造成損害,因為它會產生染色體易位和基因異常。重組反應由稱為重組酶(例如RAD51)的酵素催化。[ 142 ]重組的第一步是內切酶或 DNA 損傷引起的雙股斷裂。 [ 143 ]在重組酶部分催化下,一系列步驟導致兩個螺旋透過至少一個霍利迪連接體連接在一起,其中每個螺旋中一條單鏈的片段與另一個螺旋中的互補鏈退火。霍利迪連接是一種四面體連接結構,可以沿著染色體對移動,將一條鏈交換為另一條鏈。然後透過切割連接點並重新連接釋放的 DNA 來停止重組反應。[ 144 ]在重組過程中,只有同極性的鏈才會交換DNA。解理有兩種:東西解理和南北解理。南北方向的切割會使 DNA 兩條鏈都斷裂,而東西向的切割會使一條 DNA 鏈保持完整。重組過程中霍利迪連接體的形成使得遺傳多樣性、基因在染色體上的交換、野生型病毒基因組的表現成為可能。
演化
DNA 包含使所有生命形式能夠運作、生長和繁殖的遺傳訊息。然而,尚不清楚在 40 億年的生命歷史中,DNA 發揮這項功能已有多長時間,因為有人提出,最早的生命形式可能使用 RNA 作為其遺傳物質。[ 145 ] [ 146 ] RNA 可能充當早期細胞代謝的核心部分,因為它既可以傳遞遺傳訊息,又可以作為核酶的一部分進行催化作用。[ 147 ]在古老的RNA世界中,核酸既能起到催化作用,又能起到遺傳作用,這可能影響了目前基於四種核苷酸鹼基的遺傳密碼的進化。這種情況會發生,因為這種生物體中不同鹼基的數量是少量鹼基提高複製準確性與大量鹼基提高核酶催化效率之間的權衡。[ 148 ]然而,沒有古代遺傳系統的直接證據,因為從大多數化石中提取DNA是不可能的,因為DNA在環境中存活的時間不到一百萬年,並且在溶液中慢慢降解為短片段。[ 149 ]有人聲稱發現了更古老的 DNA,最著名的一份報告稱,有人從 2.5 億年前的鹽晶體中分離出了一種活細菌,[ 150 ]但這些說法存在爭議。[ 151 ] [ 152 ]
DNA 的組成部分(腺嘌呤、鳥嘌呤和相關的有機分子)可能是在外太空形成的。[ 153 ] [ 154 ] [ 155 ]複雜的 DNA 和RNA 有機化合物,包括尿嘧啶、胞嘧啶和胸腺嘧啶,也在模擬外太空條件的實驗室中形成,使用的起始化學物質包括嘧啶、在隕石中發現。嘧啶與多環芳烴(PAH) 一樣,是宇宙中發現的含碳量最高的化學物質,可能形成於紅巨星或星際宇宙塵埃和氣體雲中。[ 156 ]
在可以直接觀察到基因組進化的時間尺度上,人們已經從古代生物體中恢復了古代 DNA,包括從滅絕的生物體到數百萬年前的猛獁象。[ 157 ] [ 158 ]
技術用途
基因工程
已經開發出了一些方法來從生物體中純化 DNA,例如苯酚-氯仿提取法,以及在實驗室中對其進行操作的方法,例如限制性消化和聚合酶鍊式反應。現代生物學和生物化學在重組DNA技術中大量運用了這些技術。重組 DNA是由其他 DNA 序列組裝而成的人造 DNA 序列。它們可以以質粒的形式或透過病毒載體以適當的形式轉化為生物體。[ 159 ]所生產的基因改造生物可用於生產重組蛋白等產品,用於醫學研究,[ 160 ]或用於農業種植。[ 161 ] [ 162 ]
DNA 分析
法醫科學家可以利用犯罪現場的血液、精液、皮膚、唾液或頭髮中的 DNA來識別個人(例如犯罪者)的匹配 DNA。[ 163 ]這個過程正式稱為DNA 分析,也稱為DNA 指紋辨識。在 DNA 分析中,需要對不同個體的重複 DNA 片段(如短串聯重複序列和微衛星)的長度進行比較。這種方法通常是識別匹配 DNA 的極其可靠的技術。[ 164 ]然而,如果現場有多人的 DNA 污染,身分識別可能會變得複雜。[ 165 ] DNA分析技術於1984年由英國遺傳學家亞歷克·杰弗里斯爵士發明,[ 166 ]並首次應用於法醫學,在1988年恩德比謀殺案中判處科林·皮奇福克有罪。[ 167 ]
法醫學的發展以及現在透過血液、皮膚、唾液或頭髮等微量樣本獲取基因匹配的能力導致許多案件被重新審查。現在可以發現最初檢查時在科學上不可能發現的證據。再加上一些地方取消了雙重危險法,這可以允許重新審理那些先前審判未能提供足夠證據說服陪審團的案件。被指控犯有嚴重罪行的人可能會被要求提供 DNA 樣本以供匹配。對於法醫獲得的 DNA 匹配最明顯的辯護就是聲稱發生了證據交叉污染。這使得對新的嚴重犯罪案件的處理程序變得十分嚴格。
DNA 分析還可以透過與家庭成員進行匹配, 成功地用於確認大規模傷亡事件的受害者[ 168 ] 、嚴重事故中的屍體或身體部位,以及集體戰爭墳墓中的個別遇難者的身份。
DNA 分析也用於DNA 親子鑑定,以確定某人是否是孩子的親生父母或祖父母,當所謂的父母與孩子有生物學關係時,親子關係的機率通常為 99.99%。正常的DNA 定序方法在嬰兒出生後進行,但現在有新的方法可以在母親懷孕期間檢測親子關係。[ 169 ]
DNA 酶或催化 DNA
脫氧核酶,又稱 DNA 酶或催化DNA ,於1994年首次被發現。大量隨機DNA 序列中分離出來(選擇性聚焦光子學)。脫氧核糖核酸酶能催化多種化學反應,包括RNA-DNA切割、RNA-DNA連接、胺基酸磷酸化-去磷酸化、碳-碳鍵形成等。化學反應的催化速率提高100,000,000,000倍。[ 171 ]研究最廣泛的脫氧核糖核酸酶類型是 RNA 切割類型,其已被用於檢測不同的金屬離子和設計治療藥物。已報告了幾種金屬特異性DNA酶,包括GR-5 DNA酶(鉛特異性),[ 170 ] CA1-3 DNA酶(銅特異性),[ 172 ] 39E DNA酶(鈾酰特異性)和NaA43 DNA酶(鈉特異性)。[ 173 ]據報導,NaA43 DNAzyme對鈉的選擇性比其他金屬離子高出10,000多倍,可用於製造細胞內的即時鈉感測器。
生物資訊學
生物資訊學涉及儲存、資料探勘、搜尋和處理生物資料(包括 DNA核酸序列資料)的技術開發。這些導致了計算機科學的廣泛應用的進步,特別是字串搜尋演算法、機器學習和資料庫理論。[ 174 ]字串搜尋或匹配演算法可以在一個更大的字母序列中找到某個字母序列的出現,這種演算法是為了搜尋特定的核苷酸序列而開發的。[ 175 ]可以將DNA序列與其他DNA序列比對,以識別同源序列,並定位使它們有區別的特定突變。這些技術,尤其是多序列比對,用於研究系統發育關係和蛋白質功能。[ 176 ]代表整個基因組 DNA 序列的資料集(例如人類基因組計畫所產生的資料集)如果沒有標註來識別每條染色體上基因和調控元件的位置,則很難使用。基因查找演算法可以識別具有與蛋白質或 RNA 編碼基因相關的特徵模式的 DNA 序列區域,這使研究人員能夠在分離特定預測它們在生物體中的存在基因產物[ 177 ]還可以比較整個基因組,這可以揭示特定生物的演化歷史,並允許研究複雜的演化事件。
DNA奈米科技

DNA奈米技術利用DNA和其他核酸獨特的分子辨識特性來創建具有有用特性的自組裝分支DNA複合物。 [ 179 ]因此,DNA被用作結構材料,而不是生物訊息的載體。這導致了二維週期性晶格(基於瓦片和使用DNA 摺紙方法)和多面體形狀的三維結構的產生。[ 180 ] 奈米機械裝置和演算法自組裝也已被證實,[ 181 ]這些 DNA 結構已被用來模板化其他分子(如金奈米粒子和鏈黴親和素蛋白)的排列。[ 182 ] DNA和其他核酸是適體的基礎,適體是用於一系列生物技術和生物醫學應用的特定目標分子的合成寡核苷酸配體。[ 183 ]
歷史與人類學
由於DNA會隨著時間的推移而發生突變,然後被遺傳下來,因此它包含歷史訊息,透過比較DNA序列,遺傳學家可以推斷生物的演化歷史,即它們的系統發育。[ 184 ]系統發育學是演化生物學的一個強大工具。如果比較一個物種內的 DNA 序列,群體遺傳學家可以了解特定族群的歷史。這可以用於從生態遺傳學到人類學的研究。
資訊儲存
DNA 作為資訊儲存設備具有巨大的潛力,因為它的儲存密度比電子設備高得多。然而,高昂的成本、較慢的讀寫時間(記憶體延遲)以及可靠性不足阻礙了它的實際應用。[ 185 ] [ 186 ]
歷史

DNA 最早由瑞士醫生弗里德里希·米歇爾 (Friedrich Miescher)分離出來,他於 1869 年在廢棄的手術繃帶的膿液中發現了一種微觀物質。由於它存在於細胞核中,因此他將其命名為“核蛋白”。[ 187 ] [ 188 ] 1878年,阿爾布雷希特·科塞爾(Albrecht Kossel)分離出了「核蛋白」的非蛋白質成分,即核酸,隨後又分離了它的五個主要核鹼基。[ 189 ] [ 190 ]
1909年,菲比斯·利文(Phoebus Levene)發現了RNA(當時稱為「酵母核酸」)的鹼基、糖和磷酸核苷酸單元。[ 191 ] [ 192 ] [ 193 ] 1929年,Levene在「胸腺核酸」(DNA)中發現了脫氧核糖。[ 194 ]利文 (Levene) 認為,DNA 由四個核苷酸單元經由磷酸基團連接在一起所構成(「四核苷酸假說」)。 Levene 認為該鏈很短且鹼基以固定順序重複。 1927 年,尼古拉·科爾索夫 (Nikolai Koltsov)提出,遺傳特徵將透過「巨型遺傳分子」遺傳,該分子由「兩條鏡像鏈組成,每條鏈以半保守方式複製」。[ 195 ] [ 196 ]1928 年,弗雷德里克·格里菲斯 (Frederick Griffith)在他的實驗中發現,通過將殺死的“光滑”細菌與活的“粗糙”細菌混合,肺炎球菌的「光滑」形式的特性可以轉移到同一種細菌的「粗糙」形式。[ 197 ] [ 198 ]此系統首次明確顯示DNA攜帶遺傳訊息。
1933年,在研究處女海膽卵時,Jean Brachet提出 DNA 存在於細胞核中,而RNA僅存在於細胞質中。當時人們認為「酵母核酸」(RNA)僅存在於植物中,而「胸腺核酸」(DNA)僅存在於動物中。後者被認為是四聚體,具有緩衝細胞 pH 值的功能。[ 199 ] [ 200 ]
1937 年,威廉·阿斯特伯里 (William Astbury)製作了第一個 X 射線衍射圖,顯示 DNA 具有規則結構。[ 201 ]
1943 年,奧斯瓦爾德艾佛瑞 (Oswald Avery ) 與同事柯林麥克勞德 (Colin MacLeod)和麥克林麥卡錫 (Maclyn McCarty ) 發現 DNA 是轉化原理,支持了格里菲斯的假設(艾弗里-麥克勞德-麥卡錫實驗)。[ 202 ] 埃爾文·查加夫發展並發表了現在被稱為查加夫規則的觀察結果,該規則指出,在任何生物的任何物種的DNA中,鳥嘌呤的量應等於胞嘧啶,腺嘌呤的量應等於胸腺嘧啶。[ 203 ] [ 204 ]

1951 年末,弗朗西斯·克里克開始與詹姆斯·沃森在劍橋大學卡文迪許實驗室一起工作。1952 年,阿爾弗雷德·赫爾希 (Alfred Hershey)和瑪莎·蔡斯 (Martha Chase)在赫爾希-蔡斯實驗中證明,DNA 是腸道細菌噬菌體 T2的遺傳物質,從而證實了DNA 在遺傳中的作用。[ 205 ]
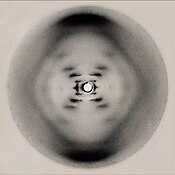
1952 年 5 月,羅莎琳德·富蘭克林 (Rosalind Franklin)指導的研究生雷蒙德·高斯林 (Raymond Gosling)拍攝了一張高水合水平的 DNA 的X 射線衍射圖像,標記為“照片 51 ” [ 206 ] 。這張照片是莫里斯威爾金斯送給華生和克里克的,對他們獲得正確的 DNA 結構至關重要。富蘭克林告訴克里克和沃森,脊椎骨必須在外面。在此之前,萊納斯·鮑林 (Linus Pauling) 以及華生和克里克都提出了錯誤的模型,其中鏈條在內部,鹼基指向外部。富蘭克林對DNA 晶體空間群的鑑定向克里克揭示了兩條 DNA 鍊是反向平行的。[ 207 ] 1953年2月,萊納斯·鮑林和羅伯特·科里提出了一種核酸模型,該模型含有三條相互纏繞的鏈,磷酸鹽位於軸附近,鹼基位於外側。[ 208 ]沃森和克里克完成了他們的模型,現在被公認為第一個正確的DNA雙螺旋模型。 1953 年 2 月 28 日,克里克在英國劍橋老鷹酒吧打斷顧客的午餐時間,宣布他和沃森「發現了生命的秘密」。[ 209 ]
1953 年 4 月 25 日的《自然》雜誌發表了一系列五篇文章,介紹了華生和克里克的 DNA 雙螺旋結構以及支持它的證據。[ 210 ]該結構在題為“核酸的分子結構脫氧核糖核酸的結構”的信中進行了報道,他們在信中說:“我們注意到,我們假設的特定配對立即暗示了一種可能的複制機制尋找遺傳物質。[ 9 ]這封信之後,富蘭克林和戈斯林又寫了一封信,首次發表了他們自己的 X 射線衍射數據和原始的分析方法。[ 48 ] [ 211 ]隨後,威爾金斯和他的兩位同事發表了一封信,其中包含對體內B-DNA的X射線圖的分析,支持沃森和克里克結構在體內的存在。 [ 49 ]
2023 年 4 月,科學家根據新證據得出結論,羅莎琳德·富蘭克林是 DNA 發現過程中的貢獻者和“平等參與者”,而不是像發現之後所呈現的那樣。[ 212 ] [ 213 ] [ 214 ]
1962年,富蘭克林逝世後,沃森、克里克、威爾金斯共同獲得了諾貝爾生理學或醫學獎。[ 215 ]諾貝爾獎只頒發給在世的得獎者。關於誰應該獲得這一發現的榮譽的爭論仍在繼續。[ 216 ]
1957年,克里克在一次有影響力的演講中,提出了分子生物學的中心法則,預言了DNA、RNA和蛋白質之間的關係,並提出了「適配器假說」。[ 217 ] 1958 年,梅塞爾森-斯塔爾實驗最終證實了雙螺旋結構所暗示的複製機制。[ 218 ]克里克與同事的進一步研究表明,遺傳密碼基於不重疊的三聯體鹼基,稱為密碼子,這使得哈爾·戈賓德·科拉納、羅伯特·W·霍利和馬歇爾·沃倫·尼倫伯格破解了遺傳密碼。[ 219 ]這些發現標誌著分子生物學的誕生。[ 220 ]
1986 年,DNA 分析首次用於刑事調查目的,當時英國警方要求萊斯特大學的亞歷克·杰弗里斯 (Alec Jeffreys)核實或反駁嫌疑人的強姦謀殺「供詞」。在這起案件中,犯罪嫌疑人曾承認犯下兩起強姦殺人罪,但後來又翻供了。大學實驗室的 DNA 檢測很快就證明了嫌疑人最初「供詞」的真實性,嫌疑人被免除了謀殺強姦指控。[ 221 ]
參見
- 常染色體 – 除性染色體以外的任何染色體
- 晶體學 —晶體結構的科學研究
- DNA 日 -4 月 25 日慶祝節日
- DNA 微陣列 -收集附著在固體表面上的微小 DNA 點
- DNA 定序 – 確定核酸序列的過程
- 遺傳性疾病 -由一個或多個基因組異常引起的健康問題
- 遺傳譜系 -以 DNA 測試推斷親緣關係
- 單倍型 – 來自父母一方的一組基因
- 減數分裂 -細胞分裂產生單倍體配子
- 核酸符號 -使用羅馬字元 A、C、G 和 T 來表示四種 DNA 核苷酸的通用符號
- 核酸序列 – 核酸中核苷酸的連續性
- Proteopedia DNA 形式
- 核醣體 DNA – 編碼核醣體 RNA 的基因
- 南方印跡法 – DNA 分析技術
- X 射線散射技術 – 非破壞性分析技術系列
- 異種核酸 – 合成核酸類似物
參考
- “脫氧核糖核酸”。Merriam-Webster.com 字典。韋氏字典。
- Alberts B、Johnson A、Lewis J、Raff M、Roberts K 和 Walter P (2014 年)。細胞分子生物學(第 6 版)。花環。頁第 4 章:DNA、染色體和基因組。國際標準書號 978-0-8153-4432-2。原文存檔於2014年7月14日。
- Purcell A. “DNA”。基礎生物學。原文存檔於2017年1月5日。
- “尿嘧啶”。基因組學.gov 。檢索日期:2019 年11 月 21 日。
- Russell P (2001)。iGenetics。紐約:本傑明·卡明斯。國際標準書號 0-8053-4553-1。
- Saenger W (1984)。核酸結構原理。紐約:Springer-Verlag。國際標準書號 0-387-90762-9。
- Alberts B、Johnson A、Lewis J、Raff M、Roberts K 與 Peter W (2002)。細胞分子生物學(第四版)。紐約和倫敦:Garland Science。國際標準書號 0-8153-3218-1。OCLC 145080076。原文存檔於2016年11月1日。
- Irobalieva RN、Fogg JM、Catanese DJ、Catanese DJ、Sutthibutpong T、Chen M、Barker AK、Ludtke SJ、Harris SA、Schmid MF、Chiu W 和 Zechiedrich L (2015 年 10 月)。“超螺旋DNA的結構多樣性”。自然通訊。6 (1): 8440. Bibcode : 2015NatCo...6.8440I。doi : 10.1038/ncomms9440。ISSN 2041-1723。PMC 4608029。PMID 26455586。
- Watson JD,Crick FH(1953 年 4 月)。「核酸的分子結構;去氧核糖核酸的結構」(PDF)。自然。171(4356):737–38。doi:10.1038/171737a0。ISSN0028-0836。PMID13054692。S2CID4253007。原文存檔(PDF)
- Mandelkern M、Elias JG、Eden D、Crothers DM(1981 年 10 月)。 「溶液中 DNA 的尺寸」。分子生物學雜誌。152 ( 1 ) : 153– 61 。ISSN 0022-2836。PMID 7338906。
- Arrighi, Frances E.;曼德爾,曼利;伯根達爾,珍妮特; Hsu, TC (1970 年 6 月)。 「哺乳動物 DNA 的浮力密度」。生化遺傳學。4 ( 3 ) : 367–376 。 ISSN 0006-2928。PMID 4991030。S2CID 27950750。
- Berg J、Tymoczko J、Stryer L(2002 年)。生物化學。 WH Freeman 公司。國際標準書號 0-7167-4955-6。
- IUPAC-IUB 生物化學命名委員會 (CBN) (1970 年 12 月)。「核酸、多核苷酸及其成分的縮寫和符號。1970 年建議」。生化雜誌。120 ( 3 ) : 449–54 。 ISSN 0306-3283。PMC 1179624。貨號5499957。原文存檔於2007年2月5日。
- Ghosh A、Bansal M(2003 年 4 月)。 「從 A 到 Z 的 DNA 結構詞彙表」。晶體學期刊 D 卷。59(第4部分):620–26。doi:10.1107/S0907444903003251。ISSN0907-4449。PMID12657780。
- Edwards KJ、Brown DG、Spink N、Skelly JV、Neidle S。“RCSB PDB – 1D65:B-DNA 十二聚體 d(CGCAAATTTGCG)2 的分子結構。2.2 A 時螺旋槳扭曲和小槽水結構的檢查檢查解決”。www.rcsb.org 。檢索日期:2023 年3 月 27 日。
- Yakovchuk P、Protozanova E、Frank-Kamenetskii MD(2006 年)。「鹼基堆積和鹼基配對對 DNA 雙螺旋熱穩定性的貢獻」。核酸研究。34 ( 2 ) : 564–74 。 ISSN 0305-1048。PMC 1360284。PMID 16449200。
- Tropp BE(2012 年)。分子生物學(第 4 版)。馬薩諸塞州薩德伯里:瓊斯和巴利特學習公司。國際標準書號 978-0-7637-8663-2。
- Carr S (1953)。“DNA 的沃森-克里克結構”。紐芬蘭紀念大學。原文存檔於2016年7月19日。檢索日期:2016 年7 月 13 日。
- Verma S, Eckstein F (1998)。“修飾寡核苷酸:合成及使用者策略”。生物化學年度評論。67:99–134。 ISSN 0066-4154。PMID 9759484。
- Johnson TB,Coghill RD(1925年)。 「嘧啶。CIII。結核桿菌核酸結核酸中發現 5-甲基胞嘧啶」。美國化學會志。47:2838–44。 ISSN 0002-7863。
- Weigele P,Raleigh EA(2016 年 10 月)。“細菌及其病毒中修飾鹼基的生物合成和功能”。化學評論。116 ( 20 ) : 12655– 12687 。 ISSN 0009-2665。PMID 27319741。
- Kumar S、Chinnusamy V 和 Mohapatra T (2018 年)。“修飾 DNA 鹼基的表觀遺傳學:5-甲基胞嘧啶及其他”。遺傳學前沿。9 : 640。 ISSN 1664-8021。PMC 6305559。PMID 30619465。
- Carell T、Kurz MQ、Müller M、Rossa M 和Spada F(2018 年 4 月)。 「基因組中的非規範鹼基:DNA 中的調控訊息層」。應用化學。57 (16): 4296–4312 。 doi : 10.1002 / anie.201708228 。PMID 28941008。
- Wing R、Drew H、Takano T、Broka C、Tanaka S、Itakura K 和 Dickerson RE (1980 年 10 月)。 「B-DNA完整旋轉的晶體結構分析」。自然。287 ( 5784 ) : 755–58 。 doi : 10.1038/287755a0。PMID 7432492。S2CID 4315465。
- Pabo CO, Sauer RT (1984)。 「蛋白質-DNA辨識」。生物化學年度評論。53:293–321。PMID6236744。
- Nikolova EN、Zhou H、Gottardo FL、Alvey HS、Kimsey IJ 和 Al-Hashimi HM (2013 年)。「雙股 DNA 中 Hoogsteen 鹼基對的歷史記錄」。生物聚合物。99 (12 ) : 955–68 。 PMC 3844552。PMID 23818176。
- Clausen-Schaumann H、Rief M、Tolksdorf C 和 Gaub HE (2000 年 4 月)。“單一DNA分子的機械穩定性”。生物物理雜誌。78 (4): 1997–2007 . Bibcode : 2000BpJ....78.1997C .原文連結: doi : 10.1016/S0006-3495(00)76747-6 . PMC 1300792。PMID 10733978。
- Chalikian TV、Völker J、Plum GE 和 Breslauer KJ (1999 年 7 月)。“核酸雙鏈熔化熱力學的更統一圖像:通過量熱和容量技術進行表徵”。美國國家科學院院刊。96 ( 14 ) : 7853–58 。 doi : 10.1073/pnas.96.14.7853。PMC 22151。PMID 10393911。
- deHaseth PL,Helmann JD(1995 年 6 月)。 「大腸桿菌 RNA 聚合酶形成開放複合物:聚合酶誘導的雙螺旋 DNA 鏈分離機制」。分子微生物學。16 ( 5 ) : 817–24。 PMID 7476180。S2CID 24479358。
- Isaksson J、Acharya S、Barman J、Cheruku P 與 Chattopadhyaya J (2004 年 12 月)。「單股富含腺嘌呤的 DNA 和 RNA 保留了各自雙股構象的結構特徵,並顯示出堆積模式的方向差異」(PDF)。生物化學。43 ( 51 ) : 15996–6010 。 PMID 15609994。原文存檔(PDF)於 2007 年 6 月 10 日。
- Piovesan A、Pelleri MC、Antonaros F、Strippoli P、Caracausi M 與 Vitale L (2019)。「關於人類基因組的長度、重量和GC含量」。BMC 研究筆記。12(1): 106.doi: 10.1186/s13104-019-4137-z。PMC 6391780。PMID30813969。
- Gregory SG、Barlow KF、McLay KE、Kaul R、Swarbreck D、Dunham A 等人。 (2006 年 5 月)。「人類1號染色體的DNA序列和生物學註釋」。自然。441 ( 7091 ) : 315–21 。 doi : 10.1038/nature04727。PMID 16710414。
- Anderson S、Bankier AT、Barrell BG、de Bruijn MH、Coulson AR 和 Drouin J 等人。 (1981 年 4 月)。 「人類粒線體基因組的序列與組織」。自然。290 ( 5806 ) : 457–465。原文連結:https : //doi.org/10.1038/290457a0 . PMID 7219534。S2CID 4355527。
- “無標題”。原文存檔於2011年8月13日。2012 年6 月 13 日檢索。
- Satoh M、Kuroiwa T(1991 年 9 月)。 「人類細胞粒線體中多個核苷和 DNA 分子的組織」。實驗細胞研究。196(1):137–140。PMID1715276。
- Zhang D, Keilty D, Zhang ZF, Chian RC (2017 年 3 月)。「卵母細胞老化中的粒線體:目前的理解」。婦產科的事實、觀點和願景。9 ( 1 ) : 29–38 。PMID 28721182。
- DNA 兩條鏈的名稱, 存檔於 2008 年 4 月 24 日, Wayback MachineJCBN/NC-IUB 通訊 1989。
- Hüttenhofer A、Schattner P、Polacek N (2005 年 5 月)。 「非編碼 RNA:希望還是炒作?」。遺傳學趨勢。21 ( 5 ) : 289– 97 。PMID 15851066。
- Munroe SH (2004 年 11 月)。 「真核生物中反義調控的多樣性:多種機制、新興模式」。細胞生物化學雜誌。93 ( 4 ) : 664–71。 PMID 15389973。S2CID 23748148。
- Makalowska I、Lin CF、Makalowski W(2005 年 2 月)。 「脊椎動物基因組中的重疊基因」。計算生物學和化學。29 ( 1 ) : 1–12 。 PMID 15680581。
- Johnson ZI,Chisholm SW(2004 年 11 月)。「重疊基因的性質在微生物基因組中是保守的」。基因組研究。14 ( 11 ) : 2268–72 。 PMC 525685。PMID 15520290。
- Lamb RA,Horvath CM(1991 年 8 月)。“流感病毒編碼策略的多樣性”。遺傳學趨勢。7 ( 8 ) : 261–66。 PMC 7173306。PMID 1771674。
- Benham CJ,Mielke SP(2005 年)。“DNA力學” (PDF)。生物醫學工程年度評論。7:21–53。 PMID 16004565。S2CID 1427671。原文存檔(PDF)於2019年3月1日。
- Champoux JJ (2001)。 「DNA拓樸異構酶:結構、功能與機制」。生物化學年度評論。70:369–413。PMID11395412。S2CID18144189。
- Wang JC(2002 年 6 月)。 「DNA 拓樸異構酶的細胞作用:分子觀點」。自然評論分子細胞生物學。3(6):430–40。PMID12042765。S2CID205496065。
- Basu HS、Feuerstein BG、Zarling DA、Shafer RH 與 Marton LJ (1988 年 10 月)。 「溶液中的多胺對 Z-RNA 和 Z-DNA 決定簇的識別:實驗和理論研究」。生物分子結構與動力學期刊。6 ( 2 ) : 299–309。 PMID 2482766。
- 富蘭克林 RE、戈斯林 RG(1953 年 3 月 6 日)。「胸腺酸鈉纖維的結構 I. 水分的影響」 (PDF)。Acta Crystallogr。6 ( 8– 9 ) : 673– 77 。 doi : 10.1107/S0365110X53001939。原文存檔(PDF)於 2016 年 1 月 9 日。
- 富蘭克林 RE,戈斯林 RG (1953)。“鈉胸腺核纖維的結構。II。圓柱對稱帕特森函數” (PDF)。Acta Crystallogr。6 ( 8– 9 ) : 678–85 。 doi : 10.1107/S0365110X53001940。原文存檔 (PDF)於 2017 年 6 月 29 日。
- Franklin RE、Gosling RG(1953 年 4 月)。「胸腺核酸鈉中的分子結構」(PDF)。自然。171(4356):740–41。doi:10.1038/171740a0。PMID13054694。S2CID4268222。原文存檔(PDF)
- Wilkins MH、Stokes AR、Wilson HR(1953 年 4 月)。「脫氧戊糖核酸的分子結構」(PDF)。自然。171(4356):738–40。doi:10.1038/171738a0。PMID13054693。S2CID4280080。原文存檔(PDF)
- Leslie AG、Arnott S、Chandrasekaran R 和 Ratliff RL (1980 年 10 月)。 「DNA雙螺旋的多態性」。分子生物學雜誌。143 ( 1 ) : 49– 72 。PMID 7441761。
- Baianu IC (1980年)。「生物系統中的結構有序和部分無序」。公牛。數學。生物學。42 ( 4 ) : 137–41 。 S2CID 189888972。
- Hosemann R, Bagchi RN(1962年)。物質衍射的直接分析。阿姆斯特丹-紐約:北荷蘭出版社。
- Baianu IC(1978年)。“部分無序膜系統的 X 射線散射” (PDF)。晶體學報A。34 ( 5 ) : 751–53 。 doi : 10.1107/S0567739478001540。原文存檔(PDF)於 2020 年 3 月 14 日。檢索日期:2019 年8 月 29 日。
- Wahl MC,Sundaralingam M(1997 年)。 「A-DNA 雙股體的晶體結構」。生物聚合物。44 (1): 45– 63. doi : 10.1002/(SICI)1097-0282(1997)44:1<45::AID-BIP4>3.0.CO;2-#。PMID 9097733。
- Lu XJ、Shakked Z、Olson WK(2000 年 7 月)。 「配體結合 DNA 結構中的 A 型構象基序」。分子生物學雜誌。300 ( 4 ) : 819–40 。 PMID 10891271。
- Rothenburg S、Koch-Nolte F、Haag F (2001 年 12 月)。 「DNA甲基化和Z-DNA形成作為等位基因表達定量差異的介質」。免疫學評論。184:286–98。 PMID 12086319。S2CID 20589136。
- Oh DB、Kim YG、Rich A(2002 年 12 月)。“Z-DNA結合蛋白可作為體內基因表現的強效效應物”。美國國家科學院院刊。99 ( 26 ) :16666–71。 doi : 10.1073/pnas.262672699。PMC 139201。PMID 12486233。
- Palmer J (2010 年 12 月 2 日)。“嗜砷細菌可能有助於尋找外星生命”。BBC 新聞。原文存檔於2010年12月3日。2010 年12 月 2 日檢索。
- Bortman H(2010 年 12 月 2 日)。「食砷細菌為外星生命開闢了新的可能性」。太空網。原文存檔。2010 年12 月 2 日檢索。
- Katsnelson A (2010 年 12 月 2 日)。「食砷微生物或許會重新定義生命化學」。自然新聞。doi : 10.1038/news.2010.645。原文存檔於2012年2月12日。
- Cressey D (2012年10月3日)。 “「砷生命」細菌終究更喜歡磷」。《自然新聞》。doi:10.1038/nature.2012.11520。S2CID 87341731 。
- “人類端粒DNA的結構與包裝”。ndbserver.rutgers.edu 。檢索日期:2023 年5 月 18 日。
- Greider CW,Blackburn EH(1985 年 12 月)。“鑑定四膜蟲萃取液中特定的端粒末端轉移酶活性”。細胞。43(2 Pt 1):405–13。doi :/ 0092-8674(85)90170-9。PMID3907856。
- Nugent CI,Lundblad V(1998 年 4 月)。“端粒酶逆轉錄酶:成分和調節”。基因與發展。12(8):1073–85。PMID9553037。
- Wright WE、Tesmer VM、Huffman KE、Levene SD 和 Shay JW (1997 年 11 月)。「正常人類染色體的一端具有較長的富含 G 的端粒突出部分」。基因與發展。11 (21 ) : 2801–09 。 doi : 10.1101 / gad.11.21.2801。PMC 316649。PMID 9353250。
- Burge S、Parkinson GN、Hazel P、Todd AK 與 Neidle S (2006)。「四鏈體 DNA:序列、拓樸與結構」。核酸研究。34(19):5402–15。PMC 1636468。PMID17012276。
- Parkinson GN、Lee MP、Neidle S(2002 年 6 月)。 「人類端粒 DNA 平行四鏈體的晶體結構」。自然。417 ( 6891 ) :876–80 。 doi : 10.1038/nature755。PMID 12050675。S2CID 4422211。
- Griffith JD、Comeau L、Rosenfield S、Stansel RM、Bianchi A、Moss H 與 de Lange T (1999 年 5 月)。 「哺乳動物的端粒以大的雙股環結尾」。細胞。97 ( 4 ) : 503–14 。doi : 10.1016/S0092-8674(00)80760-6。PMID 10338214。S2CID 721901。
- Seeman NC (2005 年 11 月)。“DNA使得物質結構的奈米級控製成為可能”。生物物理季刊。38 ( 4 ) : 363–71。 PMC 3478329。PMID 16515737。
- Warren M(2019 年 2 月 21 日)。「四個新的 DNA 字母使生命的字母表翻了一番」。自然。566 (7745): 436. Bibcode:2019Natur.566..436W。doi : 10.1038/d41586-019-00650-8。PMID 30809059。
- Hoshika S、Leal NA、Kim MJ、Kim MS、Karalkar NB、Kim HJ 等人。 (2019 年 2 月 22 日)。「八文字 DNA 和 RNA:具有八個構建塊的遺傳系統(付費牆)」。科學。363 ( 6429 ) :884–887 。 doi : 10.1126/science.aat0971。PMC 6413494。PMID 30792304。
- Burghardt B, Hartmann AK (2007 年 2 月)。“RNA二級結構設計”。物理評論E。75( 2 ):021920 。 Bibcode:2007PhRvE..75b1920B。doi : 10.1103/PhysRevE.75.021920。PMID 17358380。S2CID 17574854。
- Reusch W. “核酸”。密西根州立大學。檢索日期:2022 年6 月 30 日。
- “如何從任何生物中提取 DNA”。猶他大學。檢索日期:2022 年6 月 30 日。
- Hu Q,Rosenfeld MG(2012)。「人類胚胎幹細胞的表觀遺傳調控」。遺傳學前沿。3 : 238。 PMC 3488762。PMID 23133442。
- Klose RJ,Bird AP(2006 年 2 月)。 「基因組 DNA 甲基化:標記及其介質」。生化科學趨勢。31 ( 2 ) : 89– 97 。PMID 16403636。
- Bird A(2002 年 1 月)。“DNA甲基化模式與表觀遺傳記憶”。基因與發展。16 ( 1 ) : 6–21 。 PMID 11782440。
- Walsh CP, Xu GL(2006)。 「胞嘧啶甲基化和 DNA 修復」。DNA 甲基化:基本機制。微生物學和免疫學的當前主題。卷301.第283-315頁 。國際標準書號 3-540-29114-8。PMID 16570853。
- Kriaucionis S、Heintz N(2009 年 5 月)。「核 DNA 鹼基 5-羥甲基胞嘧啶存在於浦肯野神經元和大腦中」。科學。324 ( 5929 ) :929–30 。 doi : 10.1126/science.1169786。PMC 3263819。PMID 19372393。
- Ratel D、Ravanat JL、Berger F、Wion D (2006 年 3 月)。“N6-甲基腺嘌呤:DNA 的另一種甲基化鹼基”。傳記散文。28 ( 3 ) : 309–15。 PMC 2754416。PMID 16479578。
- Gommers-Ampt JH、Van Leeuwen F、de Beer AL、Vliegenthart JF、Dizdaroglu M、Kowalak JA、Crain PF 和 Borst P (1993 年 12 月)。 「β-D-葡萄糖基羥甲基尿嘧啶:寄生性原生動物布氏錐蟲 DNA 中存在的一種新型修飾鹼基」。細胞。75 ( 6 ) : 1129–36。高密度脂蛋白:1874/5219。PMID 8261512。S2CID 24801094。
- 摘自PDB 1JDG, 2008 年 9 月 22 日 存檔於Wayback Machine
- Douki T、Reynaud-Angelin A、Cadet J、Sage E(2003 年 8 月)。 「雙嘧啶光產物而非氧化損傷是與太陽 UVA 輻射的遺傳毒性作用有關的 DNA 損傷的主要類型」。生物化學。42 ( 30 ) : 9221–26 。 PMID 12885257。
- Cadet J、Delatour T、Douki T、Gasparutto D、Pouget JP、Ravanat JL 和 Sauvaigo S (1999 年 3 月)。 「羥基自由基和 DNA 鹼基損傷」。突變研究。424 ( 1– 2) : 9– 21 。 doi : 10.1016/S0027-5107(99)00004-4。PMID 10064846。
- Beckman KB, Ames BN (1997 年 8 月)。“DNA的氧化衰變”。生物化學雜誌。272( 32 ) :19633–36 。 PMID 9289489。
- Valerie K,Povirk LF(2003 年 9 月)。「哺乳動物雙股斷裂修復的調控與機制」。致癌基因。22 (37): 5792–812 。 doi : 10.1038 / sj.onc.1206679。PMID 12947387。
- Johnson G (2010 年 12 月 28 日)。「挖掘史前腫瘤,並引發爭論」。《紐約時報》。 2017 年 6 月 24
日
存檔,原件來自。 - Alberts B、Johnson A、Lewis J 等。 (2002)。“癌症的可預防原因”。細胞分子生物學(第 4 版)。紐約:Garland Science。國際標準書號 0-8153-4072-9。2016 年 1 月 2 日從原件存檔
。如果一個人能夠活得足夠長,那麼他的或她的細胞中至少一個最終會累積一組足以導致癌症發展的突變,這是不可避免的。
- Bernstein H、Payne CM、Bernstein C、Garewal H 和 Dvorak K (2008 年)。「癌症和老化是未修復的 DNA 損傷的後果」。在 Kimura H、Suzuki A (eds.) 中。DNA 損傷 的 新 研究.紐約:Nova Science Publishers。第1-47頁 。 978-1-60456-581-2。原文存檔於2014年10月25日。
- Hoeijmakers JH (2009 年 10 月)。 「DNA損傷、老化和癌症」。新英格蘭醫學雜誌。361 ( 15 ) : 1475–85 。 PMID 19812404。
- Freitas AA,de Magalhães JP(2011 年)。 「對老化的 DNA 損傷理論的回顧與評估」。突變研究。728 ( 1– 2 ) : 12– 22 。 doi : 10.1016/j.mrrev.2011.05.001。PMID 21600302。
- Ferguson LR、Denny WA(1991 年 9 月)。 「吖啶的遺傳毒理學」。突變研究。258 ( 2 ) : 123–60 。 PMID 1881402。
- Stephens TD、Bunde CJ、Fillmore BJ(2000 年 6 月)。 「沙利度胺致畸作用機制」。生化藥理學。59 ( 12 ) : 1489–99 。 PMID 10799645。
- Jeffrey AM (1985)。 「化學致癌物對 DNA 的修飾」。藥理學和治療學。28 ( 2 ) : 237– 72 。PMID 3936066。
- Braña MF、Cacho M、Gradillas A、de Pascual-Teresa B 和 Ramos A (2001 年 11 月)。 「嵌入劑作為抗癌藥物」。目前的藥物設計。7 ( 17 ) : 1745– 80 。PMID 11562309。
- Venter JC、Adams MD、Myers EW、Li PW、Mural RJ、Sutton GG 等。 (2001 年 2 月)。“人類基因組序列”。科學。291 ( 5507 ) :1304–51。 doi : 10.1126/science.1058040。PMID 11181995。
- Thanbichler M、Wang SC、Shapiro L (2005 年 10 月)。「細菌核:一種高度組織化和動態的結構」。細胞生物化學雜誌。96 ( 3 ) : 506–21。 PMID 15988757。
- Wolfsberg TG、McEntyre J、Schuler GD(2001 年 2 月)。“人類基因組草圖指南”。自然。409 ( 6822 ) :824–26。 doi : 10.1038/35057000。PMID 11236998。
- Gregory TR (2005 年 1 月)。「植物和動物中的 C 值之謎:相似之處的回顧和合作的呼籲」。植物學年鑑。95 ( 1 ) : 133–46。 PMC 4246714。PMID 15596463。
- Birney E、Stamatoyannopoulos JA、Dutta A、Guigó R、Gingeras TR、Margulies EH 等人。 (2007 年 6 月)。“ENCODE試點計畫對人類基因組1%中的功能元素進行識別和分析”。自然。447 ( 7146 ) :799–816 。 doi : 10.1038/nature05874。PMC 2212820。PMID 17571346。
- Yin YW, Steitz TA. 「RCSB PDB – 1MSW:T7 RNA 聚合酶從起始轉錄到延伸轉錄轉變的結構基礎」。www.rcsb.org 。檢索日期:2023 年3 月 27 日。
- Pidoux AL、Allshire RC(2005 年 3 月)。「異染色質在著絲粒功能中的作用」。倫敦皇家學會哲學學報。 B 系列,生物科學。360 ( 1455 ) : 569–79 。 PMC 1569473。PMID 15905142。
- Harrison PM、Hegyi H、Balasubramanian S、Luscombe NM、Bertone P、Echols N、Johnson T 與 Gerstein M (2002 年 2 月)。「人類基因組中的分子化石:21 和 22 號染色體中假基因的識別和分析」。基因組研究。12 ( 2 ) : 272–80。 PMC 155275。PMID 11827946。
- Harrison PM,Gerstein M(2002 年 5 月)。 「透過永恆來研究基因組:蛋白質家族、假基因和蛋白質體進化」。分子生物學雜誌。318 ( 5 ) : 1155–74。 PMID 12083509。
- Albà M (2001)。“複製性 DNA 聚合酶”。基因組生物學。2 (1): 評論3002。doi : 10.1186/gb-2001-2-1-reviews3002。PMC 150442。PMID 11178285。
- Tani K, Nasu M (2010)。 「細胞外 DNA 在細菌生態系中的作用」。在 Kikuchi Y、Rykova EY (eds.) 中。細胞外核酸。斯普林格。第25-38頁 。國際標準書號 978-3-642-12616-1。
- Vlassov VV、Laktionov PP、Rykova EY(2007 年 7 月)。 「細胞外核酸」。傳記散文。29 ( 7 ) : 654– 67 。PMID 17563084。S2CID 32463239。
- Finkel SE、Kolter R(2001 年 11 月)。“DNA 作為營養物質:細菌能力基因同源物的新作用”。細菌學雜誌。183 ( 21 ) : 6288– 93 。PMC 100116。PMID 11591672。
- Mulcahy H、Charron-Mazenod L、Lewenza S (2008 年 11 月)。“細胞外 DNA 螯合陽離子並誘導銅綠假單胞菌生物膜產生抗生素抗藥性”。PLOS 病原體。4 (11): e1000213。doi : 10.1371/journal.ppat.1000213。PMC 2581603。PMID 19023416。
- Berne C、Kysela DT、Brun YV(2010 年 8 月)。「細菌細胞外DNA抑制生物膜內運動子代細胞的定居」。分子微生物學。77 ( 4 ) : 815–29。 PMC 2962764。PMID 20598083。
- Whitchurch CB、Tolker-Nielsen T、Ragas PC、Mattick JS (2002 年 2 月)。 「細菌生物膜形成所需的細胞外 DNA」。科學。295 ( 5559 ) : 1487 。PMID 11859186。
- Hu W, Li L, Sharma S, Wang J, McHardy I, Lux R, Yang Z, He X, Gimzewski JK, Li Y, Shi W (2012)。「DNA透過與胞外多醣相互作用建構並強化黏球菌生物膜中的細胞外基質」。PLOS ONE。7 (12): e51905。Bibcode:2012PLoSO...751905H。doi: 10.1371/journal.pone.0051905。PMC 3530553。PMID 23300576。
- Hui L, Bianchi DW (2013 年 2 月)。「人類胎兒基因組產前檢測的最新進展」。遺傳學趨勢。29 ( 2 ) : 84–91 。 PMC 4378900。PMID 23158400。
- Foote AD、Thomsen PF、Sveegaard S、Wahlberg M、Kielgast J、Kyhn LA 等。 (2012)。「研究環境 DNA(eDNA)在海洋哺乳動物基因監測中的潛在用途」。PLOS ONE。7 (8): e41781。Bibcode:2012PLoSO...741781F。doi : 10.1371/journal.pone.0041781。PMC 3430683。PMID 22952587。
- “研究人員利用附近水體中的 DNA 檢測陸地動物”。
- Sandman K、Pereira SL、Reeve JN (1998 年 12 月)。「原核生物染色體蛋白質的多樣性與核小體的起源」。細胞和分子生命科學。54 ( 12 ) : 1350–64 。 PMC 11147202。PMID 9893710。S2CID 21101836。
- Dame RT (2005 年 5 月)。「核苷相關蛋白在細菌染色質的組織和壓縮中的作用」。分子微生物學。56 ( 4 ) : 858–70。 PMID 15853876。S2CID 26965112。
- Luger K、Mäder AW、Richmond RK、Sargent DF 與 Richmond TJ (1997 年 9 月)。 「2.8 A 解析度的核小體核心粒子的晶體結構」。自然。389 ( 6648 ) : 251–60 。原文連結:https : //doi.org/10.1038/38444 . PMID 9305837。S2CID 4328827。
- Jenuwein T,Allis CD(2001 年 8 月)。“翻譯組蛋白密碼” (PDF)。科學。293( 5532 ) : 1074–80。 PMID 11498575。S2CID 1883924。原文存檔(PDF)於2017年8月8日。
- Ito T (2003)。 「核小體組裝與重塑」。修飾染色質的蛋白質複合物。微生物學和免疫學的當前主題。卷274.第1-22頁。 國際標準書號 978-3-540-44208-0。PMID 12596902。
- Thomas JO(2001 年 8 月)。 「HMG1 和 2:結構 DNA 結合蛋白」。生化學會學報。29 ( Pt 4 ) : 395–401 。PMID 11497996。
- Grosschedl R、Giese K、Pagel J (1994 年 3 月)。 「HMG 結構域蛋白:核蛋白結構組裝中的結構元素」。遺傳學趨勢。10 ( 3 ) : 94–100。 PMID 8178371。
- Iftode C、Daniely Y、Borowiec JA (1999 年)。 「複製蛋白 A (RPA):真核生物的 SSB」。生物化學和分子生物學的評論。34 ( 3 ) : 141–80。 PMID 10473346。
- Beamer LJ、Pabo CO。“RCSB PDB – 1LMB:精製的 1.8 Å λ 阻遏物-操縱子複合物晶體結構”。www.rcsb.org 。檢索日期:2023 年3 月 27 日。
- Myers LC, Kornberg RD (2000 年)。 「轉錄調控介質」。生物化學年度評論。69:729–49。 PMID 10966474。
- Spiegelman BM,Heinrich R(2004 年 10 月)。「透過調節轉錄輔活化因子進行生物控制」。細胞。119 ( 2 ) : 157–67 。 PMID 15479634。
- Li Z, Van Calcar S, Qu C, Cavenee WK, Zhang MQ, Ren B (2003 年 7 月)。「c-Myc 在伯基特淋巴瘤細胞中起著整體轉錄調控作用」。美國國家科學院院刊。100 (14 ) :8164–69 。 doi : 10.1073/pnas.1332764100。PMC 166200。PMID 12808131。
- Kostrewa D, Winkler FK. “RCSB PDB – 1RVA:Mg2+ 與 EcoRV 內切酶活性位點結合:以 2 Å 分辨率對底物和產物 DNA 複合物的晶體學研究”。www.rcsb.org 。檢索日期:2023 年3 月 27 日。
- Bickle TA、Krüger DH(1993 年 6 月)。“DNA限制生物學”。微生物學評論。57 ( 2 ) : 434– 50 。PMC 372918。PMID 8336674。
- Doherty AJ、Suh SW(2000 年 11 月)。“DNA連接酶中的結構和機械保守性”。核酸研究。28(21):4051–58。PMC 113121。PMID11058099。
- Schoeffler AJ,Berger JM(2005 年 12 月)。 「II 型拓樸異構酶機制中的結構-功能關係理解的最新進展」。生化學會學報。33 (第6部分):1465–70。PMID 16246147。
- Tuteja N, Tuteja R (2004 年 5 月)。「解開 DNA 解旋酶。基序、結構、機制和功能」(PDF)。歐洲生物化學雜誌。271 ( 10 ) : 1849–63 。 PMID 15128295。
- Joyce CM、Steitz TA(1995 年 11 月)。“聚合酶的結構和功能:主題的變化?”。細菌學雜誌。177 ( 22 ) : 6321–29。 PMC 177480。PMID 7592405。
- Hubscher U、Maga G、Spadari S (2002)。“真核 DNA 聚合酶” (PDF)。生物化學年度評論。71:133–63。 PMID 12045093。S2CID 26171993。原文存檔(PDF)於 2021 年 1 月 26 日。
- Johnson A, O'Donnell M (2005)。 「細胞 DNA 複製:複製叉處的組成部分和動力學」。生物化學年度評論。74:283–315。 PMID 15952889。
- Tarrago-Litvak L、Andréola ML、Nevinsky GA、Sarih-Cottin L、Litvak S(1994 年 5 月)。「HIV-1 的逆轉錄酶:從酵素學到治療介入」。FASEB 雜誌。8(8):497–503。 PMID7514143。S2CID39614573。
- Martinez E (2002 年 12 月)。 「真核基因轉錄中的多蛋白複合體」。植物分子生物學。50 ( 6 ) : 925–47 。 PMID 12516863。S2CID 24946189。
- Thorpe JH、Gale BC、Teixeira SC、Cardin CJ。“RCSB PDB – 1M6G:霍利迪連接點 TCGGTACCGA 的結構特徵”。www.rcsb.org 。檢索日期:2023 年3 月 27 日。
- Cremer T,Cremer C(2001 年 4 月)。 「哺乳動物細胞中的染色體區域、核結構和基因調控」。自然遺傳學評論。2 ( 4 ) : 292–301 。 PMID 11283701。S2CID 8547149。
- Pál C、Papp B、Lercher MJ (2006 年 5 月)。 「蛋白質進化的綜合觀點」。自然遺傳學評論。7 ( 5 ) : 337–48。 PMID 16619049。S2CID 23225873。
- O'Driscoll M,Jeggo PA(2006 年 1 月)。 「雙股斷裂修復的作用—來自人類遺傳學的見解」。自然遺傳學評論。7 ( 1 ) : 45–54。 PMID 16369571。S2CID 7779574。
- Vispé S, Defais M (1997 年 10 月)。 「哺乳動物 Rad51 蛋白:具有多效功能的 RecA 同源物」。生物化學。79 ( 9– 10 ): 587–92 。 doi : 10.1016 / S0300-9084(97)82007- X 。PMID 9466696。
- Neale MJ,Keeney S(2006 年 7 月)。「闡明減數分裂重組中 DNA 鏈交換的機制」。自然。442 ( 7099 ) : 153–58。 doi : 10.1038/nature04885。PMC 5607947。PMID 16838012。
- Dickman MJ、Ingleston SM、Sedelnikova SE、Rafferty JB、Lloyd RG、Grasby JA 和 Hornby DP (2002 年 11 月)。“RuvABC 分解體”。歐洲生物化學雜誌。269 ( 22 ) : 5492–501 。 PMID 12423347。S2CID 39505263。
- Joyce GF (2002 年 7 月)。 「基於 RNA 的進化的古老」。自然。418 ( 6894 ) : 214–21 。原文連結:https : //doi.org/10.1038/418214a . PMID 12110897。S2CID 4331004。
- Orgel LE (2004)。 「前生命化學和 RNA 世界的起源」。生物化學和分子生物學的評論。39 ( 2 ) : 99–123。原文連結:https: //doi.org/10409230490460765 . PMID 15217990。S2CID 4939632。
- Davenport RJ (2001 年 5 月)。 「核酶。在 RNA 世界中複製」。科學。292 (5520): 1278a-1278。doi : 10.1126/science.292.5520.1278a。PMID 11360970。S2CID 85976762。
- Szathmáry E (1992 年 4 月)。“基因字母表的最佳大小是多少?”。美國國家科學院院刊。89 ( 7 ) : 2614–18。 doi : 10.1073/pnas.89.7.2614。PMC 48712。PMID 1372984。
- Lindahl T (1993 年 4 月)。 「DNA 一級結構的不穩定性和衰變」。自然。362 ( 6422 ) :709–15 。 doi : 10.1038/362709a0。PMID 8469282。S2CID 4283694。
- Vreeland RH、Rosenzweig WD、Powers DW(2000 年 10 月)。 「從原始鹽晶體中分離出一種有 2.5 億年歷史的耐鹽細菌」。自然。407 ( 6806 ) :897–900 。原文連結:https : //doi.org/10.1038/35038060 . PMID 11057666。S2CID 9879073。
- Hebsgaard MB、Phillips MJ、Willerslev E (2005 年 5 月)。 「地質上古老的 DNA:事實還是人工製品?」。微生物學趨勢。13 ( 5 ) : 212–20 。 PMID 15866038。
- Nickle DC、Learn GH、Rain MW、Mullins JI 和 Mittler JE (2002 年 1 月)。 「奇怪的是,2.5 億年前的細菌卻擁有現代的 DNA」。分子進化雜誌。54 ( 1 ) : 134–37。 doi : 10.1007/s00239-001-0025-x。PMID 11734907。S2CID 24740859。
- Callahan MP、Smith KE、Cleaves HJ、Ruzicka J、Stern JC、Glavin DP、House CH 和 Dworkin JP (2011 年 8 月)。「碳質隕石含有大量的地外核鹼基」。美國國家科學院院刊。108 ( 34 ) : 13995–98 。 doi : 10.1073/pnas.1106493108。PMC 3161613。PMID 21836052。
- Steigerwald J (2011年8月8日)。「美國太空總署研究人員:DNA構件可以在太空中製造」。美國國家航空暨太空總署。原文存檔於2015年6月23日。2011 年8 月 10 日檢索。
- ScienceDaily 員工(2011 年 8 月 9 日)。「NASA 的證據顯示 DNA 構件可以在太空中製造」。科學日報。原文存檔於2011年9月5日。2011 年8 月 9 日檢索。
- Marlaire R(2015 年 3 月 3 日)。「美國太空總署艾姆斯研究中心在實驗室中重現了生命的構成要素」。美國國家航空暨太空總署。原文存檔於2015年3月5日。2015 年3 月 5 日檢索。
- Hunt K (2021 年 2 月 17 日)。「世界上最古老的 DNA 序列來自一頭生活在一百多萬年前的猛獁象」。CNN新聞。檢索日期:2021 年2 月 17 日。
- Callaway E (2021 年 2 月 17 日)。「百萬年前的猛獁象基因組打破了最古老古代 DNA 的記錄——凍土中保存的牙齒,有 160 萬年的歷史,表明西伯利亞是一種新的猛獁象」。自然。590 ( 7847 ) :537–538 。 doi : 10.1038/d41586-021-00436-x。ISSN 0028-0836。PMID 33597786。
- Goff SP,Berg P(1976 年 12 月)。 「建構含有 SV40 和 lambda 噬菌體 DNA 片段的混合病毒及其在培養的猴細胞中的繁殖」。細胞。9 (4 PT 2): 695–705 。 doi : 10.1016 / 0092-8674(76)90133-1。PMID 189942。S2CID 41788896。
- Houdebine LM (2007)。 「生物醫學研究中的基因改造動物模型」。目標發現和驗證評審和協議。分子生物學方法。卷360.第163–202頁。 國際標準書號 978-1-59745-165-9。PMID 17172731。
- Daniell H、Dhingra A(2002 年 4 月)。「多基因工程:生物技術令人振奮的新時代的曙光」。當前生物技術觀點。13 ( 2 ) : 136–41。 PMC 3481857。PMID 11950565。
- Job D(2002 年 11 月)。 「農業中的植物生物技術」。生物化學。84 ( 11 ) : 1105–10 。 doi : 10.1016/S0300-9084(02)00013-5。PMID 12595138。
- Curtis C, Hereward J (2017 年 8 月 29 日)。「從犯罪現場到法庭:DNA樣本的旅程」。對話。原文存檔於2017年10月22日。檢索日期:2017 年10 月 22 日。
- Collins A, Morton NE (1994 年 6 月)。“DNA 辨識的似然比”。美國國家科學院院刊。91 ( 13 ):6007–11。 doi : 10.1073/pnas.91.13.6007。PMC 44126。PMID 8016106。
- Weir BS、Triggs CM、Starling L、Stowell LI、Walsh KA 和 Buckleton J (1997 年 3 月)。 「解釋 DNA 混合物」。法醫學雜誌。42 ( 2 ) : 213–22。 PMID 9068179。S2CID 14511630。
- Jeffreys AJ、Wilson V、Thein SL(1985年)。「人類 DNA 的個體特異性『指紋』」。自然。316 ( 6023 ) :76–79 。 doi : 10.1038/316076a0。PMID 2989708。S2CID 4229883。
- “科林·皮奇福克”。 2006 年 12月14日。檢索日期:2023 年3 月 27 日。
- “大規模死亡事件中的 DNA 鑑定”。國家司法研究所。2006年9月。
- Pollack A (2012 年 6 月 19 日)。《出生前,爸爸的身分證》。《紐約時報》。ISSN 0362-4331。原文存檔於2017年6月24日。檢索日期:2023 年3 月 27 日。
- Breaker RR,Joyce GF(1994 年 12 月)。 「一種切割 RNA 的 DNA 酵素」。化學與生物學。1(4):223–29。PMID9383394。
- Chandra M、Sachdeva A、Silverman SK (2009 年 10 月)。“DNA 催化的 DNA 序列特異性水解”。自然化學生物學。5 ( 10 ) : 718–20。 PMC 2746877。PMID 19684594。
- Carmi N、Shultz LA、Breaker RR(1996 年 12 月)。“自我切割 DNA 的體外選擇”。化學與生物學。3 ( 12 ) : 1039– 46。PMID 9000012。
- Torabi SF、Wu P、McGhee CE、Chen L、Hwang K、Zheng N、Cheng J 和 Lu Y (2015 年 5 月)。「鈉特異性脫氧核糖核酸酶的體外選擇及其在細胞內感測中的應用」。美國國家科學院院刊。112 ( 19 ) :5903–08 。 doi : 10.1073/pnas.1420361112。PMC 4434688。PMID 25918425。
- Baldi P,Brunak S(2001)。生物資訊學:機器學習方法。麻省理工學院出版社。國際標準書號 978-0-262-02506-5。OCLC 45951728。
- Gusfield D (1997年1月15日)。關於字串、樹和序列的演算法:計算機科學和計算生物學。劍橋大學出版社。國際標準書號 978-0-521-58519-4。
- Sjölander K (2004 年 1 月)。 「蛋白質分子功能的系統基因體學推論:進展與挑戰」。生物資訊學。20 ( 2 ) : 170–79 。 doi : 10.1093/bioinformatics/bth021。PMID 14734307。
- DM 山 (2004 年)。生物資訊學:序列和基因組分析(第二版)。紐約冷泉港:冷泉港實驗室出版社。國際標準書號 0-87969-712-1。OCLC 55106399。
- Strong M (2004 年 3 月)。“蛋白質奈米機器”。PLOS 生物學。2 (3):E73。doi : 10.1371/journal.pbio.0020073。PMC 368168。PMID 15024422。S2CID 13222080。
- Rothemund PW (2006 年 3 月)。“折疊 DNA 以創建奈米級形狀和圖案” (PDF)。自然。440 ( 7082 ) : 297–302。 doi : 10.1038/nature04586。PMID 16541064。S2CID 4316391。
- Andersen ES、Dong M、Nielsen MM、Jahn K、Subramani R、Mamdouh W、Golas MM、Sander B、Stark H、Oliveira CL、Pedersen JS、Birkedal V、Besenbacher F、Gothelf KV 和Kjems J (2009 年5 月)。 「具有可控蓋子的奈米級 DNA 盒的自組裝」。自然。459 ( 7243 ) :73–76 。 doi : 10.1038/nature07971。型號:11858/00-001M-0000-0010-9362-B。PMID 19424153。S2CID 4430815。
- Ishitsuka Y, Ha T (2009 年 5 月)。 「DNA奈米技術:奈米機器開始運作」。自然奈米技術。4 ( 5 ) : 281–82。 doi : 10.1038/nnano.2009.101。PMID 19421208。
- Aldaye FA、Palmer AL、Sleiman HF(2008 年 9 月)。 「以DNA為指導組裝材料」。科學。321 ( 5897 ) :1795– 99 。doi : 10.1126/science.1154533。PMID 18818351。S2CID 2755388。
- Dunn MR、Jimenez RM、Chaput JC(2017 年)。“適體的發現與技術分析”。自然評論化學。1(10)。doi : 10.1038/s41570-017-0076 。檢索日期:2022 年6 月 30 日。
- Wray GA (2002)。“利用 DNA 確定生命之樹分支的年代”。基因組生物學。3 (1): 評論0001。doi : 10.1186/gb-2001-3-1-reviews0001。PMC 150454。PMID 11806830。
- Panda D、Molla KA、Baig MJ、Swain A、Behera D 和 Dash M (2018 年 5 月)。“DNA 作為數位資訊儲存設備:希望還是炒作?”。3 生物技術。8 ( 5 ) : 239。PMC 5935598。PMID 29744271。
- Akram F、Haq IU、Ali H、Laghari AT (2018 年 10 月)。 「在 DNA 中儲存數位資料的趨勢:概述」。分子生物學報告。45 ( 5 ) : 1479– 1490 。PMID 30073589。S2CID 51905843。
- Miescher F (1871年)。「論膿細胞的化學組成」。醫學化學研究(德語)。4:441–60。
456]
在接下來的一段時間裡,我將與我的同伴一起尋找整個核,身體的裂縫,我將在沒有更多解釋的情況下作為丟失和未丟失的核被釋放,一個持續的物質釋放。
(因此,在我的實驗中,我隨後將自己限制在整個原子核上,而將物質的分離留給更有利的材料,目前,在沒有進一步偏見的情況下,我將其指定為可溶和不可溶的核物質(“核素”) )
- Dahm R (2008 年 1 月)。 「發現 DNA:弗里德里希·米歇爾和核酸研究的早期階段」。人類遺傳學。122 ( 6 ) : 565–81。 PMID 17901982。S2CID 915930。
- 參見:
- Kossel A(1879)。「Ueber Nucleïn der Hefe」 [論酵母中的細胞核]。Zeitschrift für physiologische Chemie(德文)。3:284–91。
- Kossel A(1880)。「論性酵母菌中的細胞核,第 2 部分」。Zeitschrift für physiologische Chemie(德文)。4:290–95。
- Kossel A(1881)。「Ueber die Verbreitung des Hypoxanthins im Thier- und Pflanzenreich」 [關於次黃素在動物和植物界的分佈]。Zeitschrift für physiologische Chemie(德文)。5:267–71。
- Kossel A(1881)。Untersuchungen über die Nucleine und ihre Spaltungsprodukte[對核素及其裂解產物的研究](德語)。德國斯特拉斯堡:KJ Trübner。頁19.
- Kossel A(1882)。「Ueber Xanthin und Hypoxanthin」 [論黃質和次黃質]。Zeitschrift für physiologische Chemie。6:422–31。
- Albrect Kossel (1883) “Zur Chemie des Zellkerns” (關於細胞核的化學),Zeitschrift für physiologische Chemie,7:7–22。
- Kossel A(1886)。「Weitere Beiträge zur Chemie des Zellkerns」 [對細胞核化學的進一步貢獻]。Zeitschrift für Physiologische Chemie(德文)。10:248–64。
264,科塞爾(Kossel)頗具先見之明地指出:由於對四大類物質的定量關係的研究,它們對細胞的生理基礎的解釋,以及對元素生理化學過程的解釋,都具有重要的指導意義。 (研究四種含氮鹼基的定量關係——以及它們的數量對細胞生理狀態的依賴性——有望為基本生理化學過程提供重要的見解。)
- Jones ME(1953 年 9 月)。「阿爾布雷希特·科塞爾(Albrecht Kossel),傳記素描」。耶魯生物學和醫學雜誌。26 ( 1 ) : 80–97 。PMID 13103145。
- Levene PA, Jacobs WA (1909 年)。「關於肌動蛋白」。德國化學協會報告(德語)。42:1198–203。
- Levene PA, Jacobs WA (1909 年)。「關於 Hefe 核反應器」。德國化學協會報告(德語)。42 ( 2 ) : 2474– 78 。
- Levene P (1919 年)。“酵母核酸的結構”。生物化學雜誌40 ( 2 ) : 415– 24 。
- Cohen JS,葡萄牙FH(1974)。「尋找 DNA 的化學結構」(PDF)。康乃狄克醫學。38 ( 10 ) : 551–52 , 554–57。
- 科利佐夫提出,細胞的遺傳訊息被編碼在一長鏈胺基酸中。看:
- 科爾佐夫 HK(1927 年 12 月 12 日)。形態學的物理化學基礎[形態學的物理化學基礎](演講)。第三屆全聯盟動物學家、解剖學家和組織學家會議(俄語)。蘇聯列寧格勒
- 轉載自:Koltsov HK(1928)。 「形態學的物理化學基礎」。Успехи экспериментальной биологии (實驗生物學進展) 系列 B(俄語)。7 (1): ?.
- 德文重印為:Koltzoff NK (1928)。 “Physikalisch-chemische Grundlagen der Morphologie” [形態學的物理化學基礎]。Biologisches Zentralblatt(德文)。48(6): 345–69。
- 1934年,科爾索夫提出,含有細胞遺傳訊息的蛋白質可以複製。參見:Koltzoff N(1934 年 10 月)。 「果蠅唾液腺中染色體的結構」。科學。80 ( 2075 ) :312–13 。 doi : 10.1126/science.80.2075.312。PMID 17769043。
摘自第 313 頁:「我認為,果蠅唾液腺中染色體的大小是透過
基因組
的繁殖決定的。我用這個術語來表示染色體的軸線,遺傳學家在其中定位了基因;…在正常的染色體中通常只有一個基因組;在細胞分裂之前,這個基因組已經分成兩條鏈。
- Soyfer VN(2001 年 9 月)。 「政治獨裁對俄羅斯科學的影響」。自然遺傳學評論。2 ( 9 ) : 723–29。 PMID 11533721。S2CID 46277758。
- Griffith F (1928 年 1 月)。「肺炎球菌類型的意義」。衛生雜誌。27 ( 2 ) : 113–59 。 PMC 2167760。PMID 20474956。
- Lorenz MG,Wackernagel W(1994 年 9 月)。「透過環境中的自然遺傳轉化進行細菌基因轉移」。微生物學評論。58 ( 3 ) : 563– 602 。PMC 372978。PMID 7968924。
- Brachet J (1933年)。 「研究大腦發育過程中胸腺核酸的合成」。生物學檔案(義大利語)。44:519–76。
- Burian R (1994)。“讓·布拉歇的細胞化學胚胎學:與法國生物學革新有何關聯?” (PDF)。在 Debru C、Gayon J 和 Picard JF (eds.) 中。1920 - 1950 年法國的生物與醫學科學。研究史手冊。卷2. 巴黎:CNRS 出版社。第 207-20頁 。
- 參見:
- 阿斯特伯里 WT、貝爾 FO(1938 年)。「蛋白質和相關結構的X射線研究的一些最新進展」 (PDF)。冷泉港定量生物學研討會。6:109–21。原文 存檔(PDF)於2014年7月14日。
- 阿斯特伯里 WT (1947)。“核酸的X射線研究”。實驗生物學學會研討會( 1 ):66–76。原文存檔於2014年7月5日。
- Avery OT、Macleod CM、McCarty M(1944 年 2 月)。「誘導肺炎球菌類型轉化的物質的化學性質的研究:由從 III 型肺炎球菌中分離的脫氧核糖核酸級分誘導轉化」。實驗醫學雜誌。79 ( 2 ) : 137– 158 。PMC 2135445。PMID 19871359。
- Chargaff E (1950 年 6 月)。 「核酸的化學特異性及其酵素降解機制」。經驗。6 ( 6) : 201–209 。 PMID 15421335。S2CID 2522535。
- Kresge N、Simoni RD、Hill RL(2005 年 6 月)。「查加夫規則:埃爾溫‧查加夫的作品」。生物化學雜誌。280 ( 24 ) : 172–174 。
- Hershey AD, Chase M (1952 年 5 月)。「病毒蛋白和核酸在噬菌體生長中扮演獨立角色」。普通生理學雜誌。36 ( 1 ) : 39– 56 。PMC 2147348。PMID 12981234。
- “圖片和插圖:B 型胸腺核酸鈉晶體照片。“照片 51。scarc.library.oregonstate.edu 。檢索日期:2023 年5 月 18 日。
- Schwartz J (2008)。追尋基因:從達爾文到DNA。麻薩諸塞州劍橋:哈佛大學出版社。國際標準書號 978-0-674-02670-4。
- Pauling L, Corey RB (1953 年 2 月)。“核酸的擬議結構”。美國國家科學院院刊。39 ( 2 ) : 84–97 。 doi : 10.1073/pnas.39.2.84。PMC 1063734。PMID 16578429。
- Regis E (2009)。什麼是生命?牛津:牛津大學出版社。頁52. ISBN 978-0-19-538341-6。
- “DNA雙螺旋結構:50年”。自然檔案。原文存檔於2015年4月5日。
- “原始 X 射線衍射圖像”。俄勒岡州立圖書館。原文存檔於 2009 年 1 月 30 日。2011 年2 月 6 日檢索。
- Burakoff M (2023 年 4 月 25 日)。「羅莎琳德富蘭克林在 DNA 發現中的角色有了新的轉折」。美聯社新聞。檢索日期:2023 年4 月 25 日。
- Anthes E (2023 年 4 月 25 日)。「70 年後,解開羅莎琳德·富蘭克林在DNA 發現中的作用——歷史學家長期以來一直在爭論富蘭克林博士在識別雙螺旋結構中所起的作用。一篇新的觀點文章認為她是一位“同等貢獻者”。「。紐約時報。原件存檔於 2023 年 4 月 25 日。檢索日期:2023 年4 月 26 日。
- Cobb M, Comfort N (2023 年 4 月 25 日)。「羅莎琳德富蘭克林對DNA 結構的發現做出了真正的貢獻——富蘭克林在DNA 雙螺旋結構的解析過程中並不是受害者。一封被忽視的信件和一篇未發表的新聞文章(均寫於1953 年)表明,她是一位同等重要的人物」。自然。616 ( 7958 ) : 657– 660 。doi : 10.1038/d41586-023-01313-5。PMID 37100935。S2CID 258314143。
- “1962 年諾貝爾生理學或醫學獎”。諾貝爾獎網站。
- Maddox B (2003 年 1 月)。“雙螺旋和‘受冤枉的女主角’“ (PDF)自然” 421 (6921):407-08。Bibcode : 2003Natur.421..407M。doi : 10.1038 / nature01399。PMID 12540909。S2CID 4428347。2016年10月17日,原件存檔( PDF )。
- Crick FH (1955). RNA 領帶俱樂部的說明(PDF)(演講)。英國劍橋。原文存檔(PDF)於 2008 年 10 月 1 日。
- Meselson M,Stahl FW(1958 年 7 月)。“大腸桿菌中的 DNA 複製”。美國國家科學院院刊。44 ( 7 ) : 671–82。 doi : 10.1073/pnas.44.7.671。PMC 528642。PMID 16590258。
- “1968 年諾貝爾生理學或醫學獎”。諾貝爾獎網站。
- Pray L(2008)。 「DNA 結構和功能的發現:沃森和克里克」。自然教育。1 (1): 100。
- Panneerchelvam S,Norazmi MN(2003 年)。“法醫 DNA 分析與資料庫”。馬來西亞醫學科學雜誌。10 ( 2 ) : 20–26 。PMID 23386793。
進一步閱讀
- Berry A,Watson J(2003)。DNA:生命的秘密。紐約:Alfred A. Knopf。國際標準書號 0-375-41546-7。
- Calladine CR、Drew HR、Luisi BF 和 Travers AA (2003 年)。了解 DNA:分子及其工作原理。阿姆斯特丹:愛思唯爾學術出版社。國際標準書號 0-12-155089-3。
- Carina D,Clayton J(2003 年)。50 年的 DNA。貝辛斯托克:帕爾格雷夫麥克米倫出版社。國際標準書號 1-4039-1479-6。
- 賈德森 HF(1979 年)。創世的第八天:生物學革命的創造者(第二版)。冷泉港實驗室出版社。國際標準書號 0-671-22540-5。
- Olby RC(1994 年)。雙螺旋之路:DNA 的發現。紐約:多佛出版社。國際標準書號 0-486-68117-3。1974 年 10 月由 MacMillan 首次出版,由法蘭西斯·克里克作序;權威的 DNA 教科書,於 1994 年修訂,並附加了九頁的後記。
- Olby R(2003 年 1 月)。“雙螺旋的悄然亮相”。自然。421 ( 6921 ) :402–05 。 doi: 10.1038/nature01397。PMID 12540907。
- Olby RC(2009 年)。法蘭西斯‧克里克:傳記。紐約州普萊恩維尤:冷泉港實驗室出版社。國際標準書號 978-0-87969-798-3。
- Micklas D (2003)。DNA 科學:基礎課程。冷泉港出版社。國際標準書號 978-0-87969-636-8。
- Ridley M (2006)。法蘭西斯‧克里克:遺傳密碼的發現者。俄亥俄州阿什蘭:《名人傳記》,阿特拉斯圖書出版社。國際標準書號 0-06-082333-X。
- Rosenfeld I (2010)。DNA:震撼世界的分子圖解指南。哥倫比亞大學出版社。國際標準書號 978-0-231-14271-7。
- Schultz M,Cannon Z(2009)。生命本質:遺傳學和 DNA 的圖解指南。希爾和王。國際標準書號 978-0-8090-8947-5。
- 支架 GS,Watson J(1980)。雙螺旋:DNA 結構發現的個人記錄。紐約:諾頓。國際標準書號 0-393-95075-1。
- Watson J(2004 年)。DNA:生命的秘密。蘭登書屋。國際標準書號 978-0-09-945184-6。
- 威爾金斯 M (2003)。雙螺旋的第三人莫里斯威爾金斯自傳。英國劍橋:大學出版社。國際標準書號 0-19-860665-6。
外部連結
- 蛋白質的 DNA 結合位點預測
- DNA雙螺旋遊戲摘自諾貝爾獎官方網站
- 電子顯微鏡下的DNA
- 多蘭 DNA 學習中心
- 雙螺旋:DNA 的 50 年,《自然》
- 蛋白質體學 DNA
- Proteopedia DNA 形式
- ENCODE 線程探索器ENCODE 在Nature上的主頁
- 雙螺旋 1953–2003國家生物技術教育中心
- 教師遺傳教育模組— 《從頭開始的 DNA》學習指南
- PDB本月分子DNA
- “發現遺傳化學的線索”。《紐約時報》,1953 年 6 月。
- 從一開始就有 DNA另一個 DNA 學習中心網站,內容涉及從孟德爾到人類基因組計畫的 DNA、基因和遺傳。
- 加州大學聖地牙哥分校曼德維爾特別館藏圖書館收藏的弗朗西斯·克里克 1938 年至 2007 年個人文件
- 1953 年,克里克寫給他 12 歲的兒子邁克爾的七頁手寫信,描述了 DNA 的結構。參見《克里克獎章拍賣》,《自然》,2013 年 4 月 5 日。












沒有留言:
張貼留言
Love the Lord your God with all your heart and with all your soul and with all your mind.
耶 穌 對 他 說 : 你 要 盡 心 、 盡 性 、 盡 意 愛 主 ─ 你 的 神 。
—— Matthew 22:37 —— 馬 太 福 音 22:37