在生物學中,表觀遺傳學是研究在 DNA 序列沒有改變的情況下基因表現的變化。 [ 1 ]表觀遺傳學中的希臘語前綴epi- (ἐπι-「在…之上、之外、周圍」)表示在傳統的(基於 DNA 序列的)遺傳機制「之上」或「附加」的特徵。[ 2 ]表觀遺傳學通常涉及不會被細胞分裂消除的變化,並影響基因表現的調控。[ 3 ]這種對細胞和生理特徵的影響可能是環境因素造成的,也可能是正常發育的一部分。

這個術語也指變化的機制:基因組的功能相關改變,不涉及核苷酸序列的突變。產生此類變化的機制的例子是DNA 甲基化和組蛋白修飾,它們都會改變基因的表達方式,而不會改變底層DNA序列。[ 4 ]此外,非編碼RNA序列已被證明在調控基因表現中扮演關鍵角色。[ 5 ]基因表現可以透過附著在DNA沉默區域上的抑制蛋白的作用來控制。這些表觀遺傳變化可能在細胞分裂過程中持續存在,直至細胞的整個生命週期,也可能持續多代,即使它們不涉及生物體底層 DNA 序列的變化;[ 6 ]相反,非遺傳因素會導致生物體的基因表現(或「自我表達」)不同。[ 7 ]
真核生物學中表觀遺傳變化的例子是細胞分化過程。在形態發生過程中,全能幹 細胞成為胚胎的各種多能性 細胞系,進而成為完全分化的細胞。換句話說,隨著單一受精卵細胞(合子)繼續分裂,由此產生的子細胞透過活化某些基因同時抑制其他基因的表達,變成生物體中的所有不同細胞類型,包括神經元,肌肉細胞,上皮細胞,血管內皮細胞等。[ 8 ]
定義
表觀遺傳學 (epigenesis)一詞具有「額外生長」的一般意義,自 17 世紀以來一直在英語中使用。[ 9 ]在科學出版品中, 「表觀遺傳學」一詞開始出現於 20 世紀 30 年代(見右圖)。但其當代意義直到1990年代才顯現出來。[ 10 ]

2008 年冷泉港會議上,表觀遺傳性狀的概念被定義為「由染色體變化引起的、沒有 DNA 序列改變的穩定遺傳表型」 , [ 11 ]儘管包括非遺傳性狀在內的其他定義仍在廣泛使用。[ 12 ]
沃丁頓運河,20 世紀 40 年代
表觀遺傳學變化影響染色體表現的假說是由俄羅斯生物學家尼古拉·科爾佐夫提出的。[ 13 ]從其通用意義和相關形容詞表觀遺傳學來看,英國胚胎學家CH 沃丁頓於 1942 年創造了「表觀遺傳學」一詞,與表觀遺傳學來看,與瓦倫丁·海克爾的「表型遺傳學」 ( Phänogenetik )相對應。[ 14 ] 當時生物學中,「表觀遺傳」是指細胞在胚胎發育過程中從最初的全能狀態進行的分化。[ 15 ]
當沃丁頓創造這個術語時,基因的物理性質及其在遺傳中的作用還未被人們所知。他將其用作遺傳成分如何與周圍環境相互作用產生表型的概念模型;他使用“表觀遺傳景觀來比喻生物的發展。沃丁頓認為,細胞命運是在發育過程中確定的,他稱這一過程為“管道化”,就像大理石滾落到當地最低點一樣。[ 16 ]沃丁頓建議將細胞類型分化的不可逆性不斷增強想像成彈珠(類似細胞)在山谷間移動時出現的山脊。[ 17 ]
近年來,沃丁頓的表觀遺傳景觀概念已在研究細胞命運的系統動力學狀態方法的背景下得到了嚴格的形式化。 [ 18 ] [ 19 ]預期細胞命運決定會表現出某些動態,例如吸引子收斂(吸引子可以是平衡點、極限環或奇異吸引子)或振盪。[ 19 ]
當代的
1990年,羅賓·霍利迪將表觀遺傳學定義為「研究複雜生物體發育過程中基因活動的時間和空間控制機制」。[ 20 ]
該詞在生物學中的最新用法遵循更嚴格的定義。根據Arthur Riggs及其同事的定義,它是「研究基因功能中無法透過 DNA 序列變化來解釋的有絲分裂和/或減數分裂可遺傳變化」。 [ 21 ]
然而,該術語也被用來描述尚未證明可遺傳的過程,例如某些形式的組蛋白修飾。因此,有人嘗試以更廣泛的術語重新定義“表觀遺傳學”,以避免需要遺傳性的限制。例如,阿德里安·伯德 (Adrian Bird)將表觀遺傳學定義為「染色體區域的結構適應,以便記錄、發出訊號或延續改變的活動狀態」。[ 6 ]此定義包括與DNA 修復或細胞週期階段相關的瞬時修飾,以及跨多代細胞維持的穩定變化,但不包括其他變化,例如膜結構模板化和朊病毒,除非它們影響染色體功能。然而,這種重新定義並未被普遍接受,仍有爭議。[ 22 ]美國國立衛生研究院 (NIH) 的「路線圖表觀基因組學計畫」於 2008 年至 2017 年運行,該計畫使用的定義如下:「就本計畫而言,表觀遺傳學既指基因活性和表達的可遺傳變化(在細胞或個體的後代中),也指細胞轉錄年,在冷泉港會議上,人們對錶觀遺傳性狀達成了共識定義,即「在 DNA 序列沒有改變的情況下,由染色體改變而產生的穩定遺傳表型」。[ 11 ]
這個字與「遺傳學」的相似性產生了許多平行用法。 「表觀基因組」與「基因組」相對應,是指細胞的整體表觀遺傳狀態,而表觀基因體學是指對整個基因組的表觀遺傳變化進行的整體分析。[ 12 ] 「遺傳密碼」這句話也被改編為「表觀遺傳密碼」 ,用來描述一組表觀遺傳特徵,這些特徵由相同的基礎 DNA 序列在不同細胞中產生不同的表型。從極端角度來看,「表觀遺傳密碼」可以代表細胞的整體狀態,其中每個分子的位置在表觀基因組圖譜中得到說明,表觀基因組圖譜是特定基因組區域的基因表現、DNA甲基化和組蛋白修飾狀態的示意圖。更典型的是,該術語用於指系統地測量特定、相關形式的表觀遺傳資訊(例如組蛋白密碼或DNA 甲基化模式)。[需要引用]
機制
DNA的共價修飾(例如胞嘧啶甲基化和羥甲基化)或組蛋白的共價修飾(例如賴氨酸乙醯化、賴氨酸和精氨酸甲基化、絲氨酸和蘇氨酸磷酸化、賴氨酸泛素化和SUMO化)在許多類型的表觀遺傳中起著核心作用。因此,「表觀遺傳學」一詞有時被用作這些過程的同義詞。然而,這可能會產生誤導。染色質重塑並不總是遺傳的,並且並非所有表觀遺傳都涉及染色質重塑。[ 24 ] 2019年,科學文獻中出現了進一步的賴氨酸修飾,將表觀遺傳修飾與細胞代謝聯繫起來,即乳酸化。[ 25 ]

由於細胞或個體的表型受其基因轉錄的影響,可遺傳的轉錄狀態可產生表觀遺傳效應。基因表現的調控有幾個層次。基因調控的其中一種方式是透過染色質的重塑。染色質是 DNA 和與其相關的組蛋白的複合物。如果 DNA 纏繞組蛋白的方式發生變化,基因表現也會改變。染色質重塑透過兩種主要機製完成:
- 第一種方式是組成組蛋白的胺基酸的翻譯後修飾。組蛋白由長鏈胺基酸組成。如果鏈中的胺基酸發生變化,組蛋白的形狀可能會改變。 DNA 在複製過程中不會完全解開。那麼,修飾過的組蛋白就有可能被帶入 DNA 的每個新拷貝中。一旦到達那裡,這些組蛋白就可以充當模板,啟動周圍的新組蛋白以新的方式成形。透過改變周圍組蛋白的形狀,這些修飾的組蛋白可以確保在細胞分裂後維持譜系特異性的轉錄程序。
- 第二種方法是在 DNA 中加入甲基,主要在CpG 位點,將胞嘧啶轉化為5-甲基胞嘧啶。 5-甲基胞嘧啶的作用與常規胞嘧啶非常相似,與雙股 DNA 中的鳥嘌呤配對。然而,當基因啟動子和增強子區域的CpG位點出現甲基化胞嘧啶時,基因往往會受到抑制。[ 26 ] [ 27 ]當基因體內的CpG位點(轉錄起始位點以外的編碼區)存在甲基化的胞嘧啶時,基因的表達通常會增強。基因的轉錄通常依賴轉錄因子與增強子上(10 個鹼基或更少)識別序列的結合,該序列與該基因的啟動子區域相互作用(基因表達#哺乳動物轉錄中的增強子、轉錄因子、介質複合物和 DNA 環)。[ 28 ]當辨識序列中胞嘧啶甲基化時,約22%的轉錄因子受到抑制,無法結合。此外,啟動子區域甲基化的胞嘧啶可以吸引甲基-CpG 結合域(MBD) 蛋白。所有 MBD 都與核小體重塑和組蛋白去乙醯化酶複合物相互作用,導致基因沉默。此外,另一種涉及甲基化胞嘧啶的共價修飾是透過TET 酶進行的去甲基化。例如,在神經元的學習和記憶形成過程中,會發生數百次這樣的去甲基化。[ 29 ] [ 30 ]
DNA甲基化和組蛋白賴氨酸甲基化之間通常存在相互關係。[ 31 ]例如,甲基結合域蛋白 MBD1被 DNA CpG 位點的甲基化胞嘧啶吸引並與之結合,也可以與 H3K9甲基轉移酶活性結合,對賴氨酸 9 處的組蛋白 3 進行甲基化。另一方面,DNMT1進行的 DNA 維持甲基化似乎部分依賴 DNA 位點核小體上組蛋白甲基化的識別,從而對新合成的 DNA 進行胞嘧啶甲基化。[ 31 ] DNMT3A和DNMT3B進行的 DNA 甲基化與組蛋白甲基化之間存在進一步的串擾,因此 DNA 甲基化和組蛋白甲基化的全基因組分佈之間存在相關性。[ 32 ]
組蛋白狀態的遺傳機制尚不十分清楚;然而,人們對細胞分裂和分化過程中DNA甲基化狀態的遺傳機制了解甚少。甲基化狀態的遺傳性取決於某些酵素(例如DNMT1),這些酵素對 5-甲基胞嘧啶的親和力都高於胞嘧啶。如果這種酵素到達 DNA 的「半甲基化」部分(其中 5-甲基胞嘧啶僅存在於兩條 DNA 鏈中的一條中),則該酵素就會甲基化另一半。然而,現在已知 DNMT1 與蛋白質UHRF1發生物理交互作用。 UHRF1 最近被認為對 DNMT1 介導的 DNA 甲基化維持至關重要。 UHRF1 是特異性識別半甲基化 DNA 的蛋白質,因此將 DNMT1 帶到其底物以維持 DNA 甲基化。[ 32 ]


儘管組蛋白修飾發生在整個序列中,但組蛋白的非結構化 N 端(稱為組蛋白尾)的修飾尤其嚴重。這些修飾包括乙醯化、甲基化、泛素化、磷酸化、SUMO化、核糖基化和瓜氨酸化。在這些修飾中,乙醯化是研究最深入的。例如,組蛋白乙醯轉移酶(HAT)對組蛋白 H3 尾部 K14 和 K9賴氨酸的乙醯化通常與轉錄能力相關[ 34 ](見圖)。
一種思考模式是,乙醯化與「主動」轉錄相關的趨勢本質上是生物物理的。由於賴氨酸末端通常帶有帶正電荷的氮,因此賴氨酸可以與 DNA 骨架上帶負電荷的磷酸鹽結合。乙醯化事件將側鏈上帶正電荷的胺基轉化為中性醯胺鍵。這會去除正電荷,從而使 DNA 從組蛋白上鬆開。當這種情況發生時,SWI/SNF等複合物和其他轉錄因子可以與 DNA 結合併允許轉錄發生。這是表觀遺傳功能的「順式」模型。換句話說,組蛋白尾部的變化會直接影響 DNA 本身。[ 35 ]
表觀遺傳功能的另一個模型是「反式」模型。在這個模型中,組蛋白尾部的變化間接作用於 DNA。例如,賴氨酸乙醯化可能為染色質修飾酶(或轉錄機制)創建結合位點。這種染色質重塑劑可以導致染色質狀態的改變。事實上,溴結構域(一種特異性結合乙醯賴氨酸的蛋白質結構域)存在於許多有助於活化轉錄的酵素中,包括SWI/SNF複合物。乙醯化可能以這種方式和以前的方式起作用來幫助轉錄活化。
組蛋白甲基化也證實了修飾作為相關因子對接模組的觀點。組蛋白 H3 的離胺酸 9 甲基化長期以來被認為與組成性轉錄沉默染色質(組成性異染色質)有關(見下圖)。已經確定轉錄抑制蛋白HP1中的染色質結構域(特異性結合甲基賴氨酸的結構域)會將 HP1 募集到 K9 甲基化區域。一個似乎反駁這種甲基化生物物理模型的例子是,組蛋白 H3 在賴氨酸 4 處的三甲基化與轉錄活化密切相關(並且是完全轉錄活化所必需的)(見上圖)。在這種情況下,三甲基化會在尾部引入固定的正電荷。
研究表明,組蛋白賴氨酸甲基轉移酶 (KMT) 負責組蛋白 H3 和 H4 模式中的這種甲基化活性。此酵素利用稱為 SET 結構域(雜色抑制因子、Zeste 增強因子、Trithorax)的催化活性位點。 SET 結構域是一個 130 個胺基酸序列,參與調節基因活動。已證實該結構域能夠與組蛋白尾部結合併導致組蛋白甲基化。[ 36 ]
不同的組蛋白修飾可能以不同的方式發揮作用;一個位置的乙醯化可能與另一個位置的乙醯化發揮不同的作用。而且,多種修飾可能同時發生,這些修飾可能共同作用,改變核小體的行為。多種動態修飾以系統化且可重複的方式調節基因轉錄的想法被稱為組蛋白密碼,儘管組蛋白狀態可以作為數位資訊載體線性讀取的想法已在很大程度上被推翻。最容易理解的調控染色質沉默的系統之一是基於SIR 蛋白的酵母隱藏交配型基因座 HML 和 HMR 的沉默。
DNA甲基化
DNA甲基化經常發生在重複序列中,並有助於抑制「轉座因子」的表達和移動:[ 37 ]因為5-甲基胞嘧啶可以自發脫氨(用氧取代氮)為胸腺嘧啶,所以CpG位點經常發生突變,並且在基因組中變得稀有,除了在CpG島,它們保持未甲基化的狀態。因此,這種類型的表觀遺傳變化有可能導致永久性基因突變頻率的增加。已知 DNA 甲基化模式是透過至少三種獨立的DNA 甲基轉移酶 DNMT1、DNMT3A 和 DNMT3B的複雜相互作用建立和修改的,以響應環境因素,其中任何一種酶的喪失都會對小鼠造成致命的後果。[ 38 ] DNMT1 是體細胞中最豐富的甲基轉移酶,[ 39 ]定位於複製中心,[ 40 ]對半甲基化的 DNA 有 10-40 倍的偏好,並與增殖細胞核抗原(PCNA) 相互作用。[ 41 ]
透過優先修飾半甲基化的DNA,DNMT1在DNA複製後將甲基化模式轉移到新合成的鏈上,因此通常被稱為「維持」甲基轉移酶。[ 42 ] DNMT1 對於正常的胚胎發育、印記和 X 染色體失活至關重要。[ 38 ] [ 43 ]為了強調這種遺傳分子機制與典型的華生-克里克鹼基配對遺傳訊息傳遞機制的區別,引入了「表觀遺傳模板」這個術語。[ 44 ]此外,除了DNA甲基化狀態的維持與傳遞之外,同樣的原理也適用於組蛋白修飾,甚至細胞質(結構)可遺傳狀態的維持與傳遞。[ 45 ]
RNA甲基化
N6-甲基腺苷(m6A)的RNA甲基化作為最豐富的真核RNA修飾,最近被公認為重要的基因調控機制。[ 46 ]
組蛋白修飾
組蛋白 H3 和 H4 也可以透過組蛋白賴氨酸去甲基化酶(KDM)進行去甲基化操作。這種最近發現的酵素具有一個稱為 Jumonji 結構域 (JmjC) 的催化活性位點。當 JmjC 利用多種輔因子羥基化甲基,從而將其去除時,就會發生去甲基化。 JmjC 能夠對單甲基化、二甲基化和三甲基化底物進行去甲基化。[ 47 ]
染色體區域可以採用穩定且可遺傳的替代狀態,導致雙穩態基因表達,而無需改變 DNA 序列。表觀遺傳控制通常與組蛋白的替代共價修飾有關。[ 48 ]較大染色體區域狀態的穩定性和遺傳性被認為涉及正回饋,其中修飾的核小體會募集類似地修飾附近核小體的酵素。[ 49 ]這裡找到了此類表觀遺傳學的簡化隨機模型。[ 50 ] [ 51 ]
已有研究顯示基於染色質的轉錄調控可能由小RNA介導。小幹擾RNA可以透過標靶啟動子的表觀遺傳調控來調控轉錄基因的表現。[ 52 ]
RNA轉錄本
有時,一個基因一旦被激活,就會轉錄出一種直接或間接維持自身活性的產物。例如,Hnf4和MyoD透過它們編碼的蛋白質的轉錄因子活性分別增強許多肝臟特異性和肌肉特異性基因(包括它們自己的基因)的轉錄。 RNA訊號傳導包括在分化和發育過程中,RNA將多種通用染色質修飾複合物和DNA甲基轉移酶差異募集到特定位置。[ 53 ]其他表觀遺傳變化是由不同剪接形式的RNA的產生或雙股 RNA ( RNAi ) 的形成所介導的。即使基因活化的原始刺激不再存在,基因被活化的細胞的後代也會繼承這種活動。這些基因通常透過訊號傳導來開啟或關閉,儘管在某些合體或間隙連接很重要的系統中,RNA 可以透過擴散直接擴散到其他細胞或細胞核。母體在卵子發生過程中或透過滋養細胞向受精卵提供大量的RNA和蛋白質,從而產生母體效應表型。雖然從父親遺傳下來的精子RNA數量較少,但最近有證據表明,這種表觀遺傳訊息可以導致幾代後代發生明顯的變化。[ 54 ]
微小RNA
微小RNA (miRNA)是非編碼RNA的成員,其大小範圍為17至25個核苷酸。 miRNA 調節植物和動物的多種生物學功能。[ 55 ] 2013 年到目前為止,人類已經發現了大約 2000 個 miRNA,這些 miRNA 可以在 miRNA 資料庫中在線找到。[ 56 ]細胞中表達的每個 miRNA 可能靶向它下調的大約 100 到 200 個信使 RNA (mRNA)。[ 57 ]大多數 mRNA 的下調是透過引起目標 mRNA 的衰變而發生的,而一些下調發生在翻譯成蛋白質的水平。[ 58 ]
看來約有 60% 的人類蛋白質編碼基因受 miRNA 調控。[ 59 ]許多 miRNA 受到表觀遺傳調控。約 50% 的 miRNA 基因與CpG 島相關[ 55 ],這些基因可能受到表觀遺傳甲基化的抑制。甲基化的CpG島的轉錄受到強烈且可遺傳的抑制。[ 60 ]其他 miRNA 受組蛋白修飾或 DNA 甲基化和組蛋白修飾的共同調控。[ 55 ]
信使RNA
2011年,證明mRNA甲基化在人體能量穩態中扮演關鍵角色。研究表明,與肥胖相關的FTO 基因能夠使RNA 中的N6-甲基腺苷去甲基化。 [ 61 ] [ 62 ]
sRNA
sRNA是存在於細菌中的小型(50-250 個核苷酸)、高度結構化、非編碼的 RNA 片段。它們控制病原體中的基因表現(包括毒力基因),被視為對抗抗藥性細菌的新目標。[ 63 ]它們在許多生物過程中發揮重要作用,與原核生物中的 mRNA 和蛋白質標靶結合。它們的系統發育分析(例如透過 sRNA-mRNA 標靶相互作用或蛋白質結合特性)用於建立綜合資料庫。[ 64 ]也建構了基於微生物基因組中標靶的sRNA基因圖譜。 [ 65 ]
長鏈非編碼RNA
大量研究表明,長鏈非編碼RNA(lncRNA)在調控基因表現和染色體修飾方面起著關鍵作用,從而對細胞分化發揮重要的控製作用。這些長的非編碼RNA也有助於基因組印記和X染色體的失活。[ 66 ] 在無脊椎動物中,例如蜜蜂這種社會性昆蟲,長鏈非編碼RNA被檢測出是一種可能的表觀遺傳機制,透過等位基因特異性基因,可以導致透過正反交配而產生的攻擊性。[ 67 ]
朊病毒
朊病毒是一種具有傳染性的蛋白質。一般來說,蛋白質會折疊成執行不同細胞功能的離散單元,但有些蛋白質也能夠形成稱為朊病毒的傳染性構象狀態。儘管朊病毒經常在傳染病的背景下被看待,但它的定義更為寬泛,即它能夠將同一蛋白質的其他天然狀態版本催化轉化為傳染性構象狀態。從後一種意義上講,它們可以被視為能夠在不改變基因組的情況下誘導表型變化的表觀遺傳因子。[ 68 ]
有些人認為真菌朊病毒是表觀遺傳的,因為朊病毒引起的傳染性表型可以在不改變基因組的情況下遺傳。PSI+和 URE3 分別於 1965 年和 1971 年在酵母菌中被發現,是此類朊病毒中研究最深入的兩種。[ 69 ] [ 70 ]朊病毒可以透過在聚集體中隔離蛋白質產生表型效應,進而降低蛋白質的活性。在 PSI+ 細胞中,Sup35 蛋白(參與翻譯終止)的缺失導致核醣體對終止密碼子的讀取率更高,而這種效應導致其他基因的無義突變受到抑制。 [ 71 ] Sup35 形成朊病毒的能力可能是保守的特性。它可以使細胞切換到 PSI+ 狀態並表達通常由終止密碼子突變終止的休眠遺傳特徵,從而賦予細胞適應性優勢。 [ 72 ] [ 73 ] [ 74 ] [ 75 ]
分子基礎
表觀遺傳變化會改變某些基因的激活,但不會改變 DNA 的遺傳密碼序列。[ 77 ] DNA本身的微結構(而非代碼)或相關染色質蛋白可能會改變,導致活化或沉默。這種機制使得多細胞生物中的分化細胞能夠僅表達其自身活動所必需的基因。細胞分裂時,表觀遺傳學變化得以保留。大多數表觀遺傳變化僅發生在一個生物體的生命週期內;然而,這些表觀遺傳變化可以透過稱為跨代表觀遺傳的。此外,如果在導致受精的精子或卵細胞中發生基因失活,這種表觀遺傳修飾也可能轉移到下一代。[ 78 ]
具體的表觀遺傳過程包括副突變、書籤、印跡、基因沉默、X 染色體失活、位置效應、DNA 甲基化重編程、橫導、母體效應、致癌作用的進展、致畸劑的多種影響、組蛋白修飾和異染色質的調控、影響孤雌生殖和克隆的技術限制。[ 79 ] [ 80 ] [ 81 ]
DNA損傷
DNA損傷也會造成表觀遺傳學變化。[ 82 ] [ 83 ] [ 84 ] DNA損傷非常頻繁,人體每個細胞每天平均發生約60,000次(參見DNA損傷(自然發生))。這些損傷大部分都得到了修復,然而表觀遺傳學變化仍可能存在於 DNA 修復部位。[ 85 ]具體來說,DNA雙股斷裂可透過引起DNA甲基化以及促進沉默類型的組蛋白修飾(染色質重塑 - 參見下一節)來啟動非程序性的表觀遺傳基因沉默。[ 86 ]此外,作為修復過程的一部分,酶Parp1(聚(ADP)-核糖聚合酶)及其產物聚(ADP)-核糖(PAR)會在DNA損傷部位積聚。[ 87 ]這種累積反過來指導染色質重塑蛋白 ALC1 的募集和激活,從而導致核小體重塑。[ 88 ]例如,核小體重塑已被發現會導致 DNA 修復基因 MLH1 的表觀遺傳沉默。[ 21 ] [ 89 ]苯、對苯二酚、苯乙烯、四氯化碳和三氯乙烯等DNA損傷化學物質,會導致DNA顯著低甲基化,有些是透過活化氧化壓力途徑來實現的。[ 90 ]
眾所周知,食物會改變不同飲食的大鼠的表觀遺傳學。[ 91 ]一些食物成分透過表觀遺傳學方式提高DNA修復酶(如MGMT、MLH1 [ 92 ]和p53)的含量。[ 93 ]其他食物成分可以減少DNA損傷,例如大豆異黃酮。在一項研究中,透過補充大豆的三週飲食,氧化壓力標記(例如 DNA 損傷導致的修飾核苷酸)有所減少。[ 94 ]食用富含花青素的越橘(Vaccinium myrtillius L.)果渣萃取物2 小時後,也觀察到氧化性 DNA 損傷減少。[ 95 ]
DNA修復
DNA損傷非常常見,並且不斷修復。表觀遺傳改變可以伴隨氧化損傷或雙股斷裂的 DNA 修復。在人體細胞中,氧化性 DNA 損傷每天發生約 10,000 次,DNA 雙股斷裂在體細胞複製細胞中每個細胞週期發生約 10 至 50 次(參見DNA 損傷(自然發生))。 DNA修復的選擇性優勢是讓細胞在DNA損傷面前存活。 DNA修復過程中發生的表觀遺傳改變的選擇性優勢尚不清楚。[需要引用]
氧化性DNA損傷的修復可以改變表觀遺傳標記
在穩定狀態下(內源性損傷發生並修復),哺乳動物細胞 DNA 中平均約有 2,400 個氧化損傷的鳥嘌呤,它們會形成8-氧代-2'-脫氧鳥嘌呤(8-OHdG)。 [ 96 ] 8-OHdG 約佔 DNA 中常見的氧化損傷的 5%。[ 97 ]在DNA的所有鳥嘌呤中,氧化的鳥嘌呤並不是隨機出現的。在甲基化的 CpG 位點上,鳥嘌呤具有序列偏好(胞嘧啶沿5' → 3' 方向後接鳥嘌呤,此處胞嘧啶被甲基化 (5-mCpG))。[ 98 ] 5-mCpG 位點對鳥嘌呤氧化具有最低的電離勢。[需要引用]

氧化鳥嘌呤具有錯配潛力並具有致突變性。[ 100 ] 氧鳥嘌呤糖基化酶(OGG1)是DNA修復過程中負責切除氧化鳥嘌呤的主要酵素。 OGG1 在幾秒鐘內找到並與 8-OHdG 結合。[ 101 ]然而,OGG1 不會立即切除 8-OHdG。在 HeLa 細胞中,8-OHdG 的半衰期為 30 分鐘[ 102 ],在接受輻照的小鼠中,小鼠肝臟中誘導的 8-OHdG 的半衰期為 11 分鐘。[ 97 ]
當 OGG1 出現在甲基化CpG 位點內的氧化鳥嘌呤處時,它會募集TET1至 8-OHdG 損傷處(見圖)。這使得 TET1 能夠使相鄰的甲基化胞嘧啶去甲基化。胞嘧啶去甲基化是一種表觀遺傳改變。[需要引用]
例如,當用 H2O2 處理人類乳腺上皮細胞6小時後,DNA 中的 8-OHdG 增加了約 3.5 倍,這導致基因組中 5-甲基胞嘧啶約 80% 去甲基化。[ 99 ] TET酶活性使基因啟動子上的 CpG 去甲基化,從而增加基因轉錄成信使 RNA。[ 103 ]在 H 2O 2處理的細胞中,我們檢測了一個特定的基因,即 BACE1。[ 99 ] BACE1 CpG 島的甲基化程度降低(表觀遺傳學改變),這使得BACE1信使 RNA 的表達增加了約 6.5 倍。[需要引用]
雖然與 H 2 O 2一起孵育六小時會導致 5-mCpG 位點大量去甲基化,但較短時間的 H 2 O 2孵育似乎會促進其他表觀遺傳學改變。以H2O2處理細胞30 分鐘會導致錯配修復蛋白異二聚體 MSH2-MSH6 募集 DNA 甲基轉移酶 1 ( DNMT1 )至某些氧化性 DNA 損傷的部位。[ 104 ]這可能導致這些位置的胞嘧啶甲基化增加(表觀遺傳學改變)。
江等人[ 105 ]以造成氧化性DNA損傷的物質(溴酸鉀(KBrO3)或鉻酸鉀(K2CrO4))處理HEK 293細胞。氧化損傷的鹼基切除修復(BER) 發生在 DNA 修復酶聚合酶 β定位到氧化鳥嘌呤時。聚合酶β是氧化性DNA損傷短片段BER中的主要人類聚合酶。江等人[ 105 ]也發現聚合酶 β 募集DNA 甲基轉移酶蛋白 DNMT3b 至 BER 修復位點。然後,他們評估了包括BRCA1基因啟動子區和早期轉錄區在內的一小段 DNA 區域中單核苷酸水平的甲基化模式。溴酸鹽造成的氧化性 DNA 損傷改變了所研究 DNA 區域內 CpG 位點的 DNA 甲基化模式(導致表觀遺傳學改變)。在未處理的細胞中,位於 BRCA1 基因 -189、-134、-29、-19、+16 和 +19 處的 CpG 具有甲基化的胞嘧啶(其中編號來自信使 RNA轉錄起始位點,負數表示上游啟動子區域中的核苷酸)。溴酸鹽處理引起的氧化導致 -189、-134、+16 和 +19 處的胞嘧啶甲基化的缺失,同時也導致在 DNA 修復後位於 -80、-55、-21 和 +8 處的 CpG 形成新的甲基化。
同源重組修復改變表觀遺傳標記
至少有四篇文章報告了DNA 甲基轉移酶 1 (DNMT1)被募集到 DNA 雙股斷裂位點。[ 106 ] [ 85 ] [ 107 ] [ 108 ]在雙股斷裂的同源重組修復(HR)過程中,DNMT1 的參與導致兩條修復的 DNA 鏈具有不同程度的甲基化胞嘧啶。一條鏈經常在修復的雙股斷裂下游約 21 個CpG 位點發生甲基化。另一條 DNA 鏈在雙股斷裂下游約 6 個已甲基化的 CpG 位點失去甲基化,同時在雙股斷裂上游約 5 個已甲基化的 CpG 位點失去甲基化。當染色體複製時,會產生一個子染色體,該子染色體在先前斷裂位點的下游被嚴重甲基化,而另一個子染色體在先前斷裂位點的上游和下游區域均未被甲基化。對於因雙股斷裂而斷裂的基因,一半的子代細胞以高水平表達該基因,而在另一半子代細胞中,該基因的表達受到抑制。當這些細胞的克隆維持三年時,新的甲基化模式也會在這段時間內維持下去。[ 109 ]
在基因組中存在 CRISPR 介導的同源性定向重組插入的小鼠中,雙股斷裂相關插入內的 CpG 位點甲基化大量增加。[ 110 ]
非同源末端連接可導致一些表觀遺傳標記改變
非同源末端連接(NHEJ) 修復雙股斷裂可導致修復的雙股斷裂下游少量預先存在的胞嘧啶 DNA 甲基化發生去甲基化。[ 85 ] Allen等人的進一步研究。[ 111 ]研究表明,細胞中 DNA 雙股斷裂的 NHEJ 可能導致一些子代細胞中最初雙股斷裂基因的表達受到抑制,而一些子代細胞由於與 NHEJ 修復相關的表觀遺傳改變而具有該基因的高表達。 NHEJ 修復基因中的 DNA 雙股斷裂後,導致基因抑制的表觀遺傳改變的頻率可能約為 0.9%。[ 107 ]
用於研究表觀遺傳學的技術
表觀遺傳學研究利用廣泛的分子生物學技術來進一步了解表觀遺傳現象。這些技術包括染色質免疫沉澱(及其大規模變異ChIP-on-chip和ChIP-Seq)、螢光原位雜交、甲基化敏感限制酶、DNA 腺嘌呤甲基轉移酶鑑定(DamID)和亞硫酸氫鹽定序。[ 112 ]此外,生物資訊學方法的使用在計算表觀遺傳學中發揮作用。[ 112 ]
染色質免疫沉澱
染色質免疫沉澱 (ChIP) 有助於彌合 DNA 和表觀遺傳相互作用之間的差距。[ 113 ]利用 ChIP,研究人員能夠發現基因調控、轉錄機制和染色質結構的資訊。[ 113 ]
螢光原位雜交
螢光原位雜交(FISH)對於理解表觀遺傳機制非常重要。[ 114 ] FISH 可用來找出基因在染色體上的位置,以及尋找非編碼 RNA。[ 114 ] [ 115 ] FISH 主要用於檢測人類染色體異常。[ 115 ]
甲基化敏感的限制酶
甲基化敏感限制酶與 PCR 配對是評估 DNA 甲基化(特別是 CpG 位點)的一種方法。[ 116 ]如果DNA被甲基化,限制性酵素就不會切割該鏈。[ 116 ]相反,如果DNA沒有被甲基化,酵素就會裂解DNA鏈,並以PCR擴增。[ 116 ]
亞硫酸氫鹽測序
亞硫酸氫鹽定序是評估 DNA 甲基化的另一種方法。胞嘧啶經亞硫酸氫鈉處理後會轉變為尿嘧啶,而甲基化的胞嘧啶則不會受到影響。[ 116 ] [ 117 ] [ 118 ]
奈米孔定序
某些定序方法,例如奈米孔定序,允許對天然 DNA 進行定序。天然(未擴增)DNA保留了表觀遺傳修飾,否則這些修飾會在擴增步驟中流失。奈米孔鹼基調用模型可以區分錶觀遺傳修飾鹼基和未改變鹼基的訊號,並在定序結果之外提供表觀遺傳譜。[ 119 ]
結構繼承
在四膜蟲和草履蟲等纖毛蟲中,基因相同的細胞在其細胞表面纖毛行的模式上表現出可遺傳的差異。實驗改變的模式可以傳遞給子細胞。現有的結構似乎可以作為新結構的範本。這種遺傳機制尚不清楚,但有理由假設多細胞生物也使用現有的細胞結構來組裝新的細胞結構。[ 120 ] [ 121 ] [ 122 ]
核小體定位
真核生物基因組具有眾多核小體。核小體的位置不是隨機的,並決定了DNA對調節蛋白的可及性。研究表明,在不同組織中活躍的啟動子具有不同的核小體定位特徵。[ 123 ]這決定了基因表現和細胞分化的差異。研究表明,至少有一些核小體保留在精子細胞中(其中大多數但不是全部組蛋白被魚精蛋白取代)。因此核小體的定位在某種程度上是可遺傳的。最近的研究揭示了核小體定位與其他表觀遺傳因素(例如 DNA 甲基化和羥甲基化)之間的關聯。[ 124 ]
組蛋白變體
不同的組蛋白變異體被非隨機地整合到基因組的特定區域。它們不同的生化特性可以透過在基因調控[ 125 ]和染色體結構維持中的作用來影響基因組功能。 [ 126 ]
基因組結構
基因組的三維結構(3D基因組)複雜、動態,對於調節基因組功能和核過程(如DNA複製、轉錄和DNA損傷修復)至關重要。[ 127 ]
功能和後果
在大腦中
記憶
記憶的形成和維持是由於表觀遺傳改變引起的,這種改變導致基因轉錄發生所需的動態變化,從而產生和更新神經元中的記憶。[ 30 ]
一個事件可以引發一系列反應,導致神經元中大量基因的甲基化改變,從而形成對此事件的表徵,即記憶。[ 30 ]
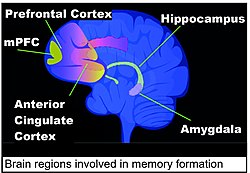
大腦中對記憶形成重要的區域包括海馬體、內側前額葉皮質 (mPFC)、前扣帶皮質和杏仁核,如本節的人類腦圖所示。[ 128 ]
當強烈記憶形成時,例如在受到情境恐懼條件作用(CFC) 的老鼠身上,最早發生的事件之一就是海馬體和內側前額葉皮質 (mPFC) 的神經元中的拓撲異構酶 IIB形成超過 100 個 DNA雙股斷裂。[ 129 ]這些雙股斷裂位於特定位置,可活化對記憶形成十分重要的立即早期基因(IEG)的轉錄,使其在mRNA中表達,並在 CFC 後 7 至 10 分鐘內達到 mRNA 轉錄高峰。[ 129 ] [ 130 ]
記憶形成中的兩個重要 IEG 是EGR1 [ 131 ]和DNMT3A的替代啟動子變體DNMT3A2。[ 132 ] EGR1 蛋白在其結合基序 5′-GCGTGGGCG-3′ 或 5′-GCGGGGGCGG-3' 與 DNA 結合,EGR1 蛋白可結合的基因組位置約有 12,000 個。[ 133 ] EGR1蛋白與基因啟動子和增強子區域的DNA結合。 EGR1 招募去甲基化酶TET1進行結合,並將 TET1 帶到基因組上的約 600 個位置,然後 TET1 可以在這些位置去甲基化並激活相關基因。[ 133 ]

DNA 甲基轉移酶 DNMT3A1、DNMT3A2 和 DNMT3B 均可甲基化基因啟動子內或附近的CpG 位點的胞嘧啶(請參閱本節圖)。如同 Manzo 等人所顯示的[ 134 ] ,這三種 DNA 甲基轉移酶在基因組結合位置和不同調控位點的 DNA 甲基化活性方面有所不同。 Manzo等人定位到 3,970 個專門富集 DNMT3A1 的基因組區域、3,838 個 DNMT3A2 的區域以及 3,432 個 DNMT3B 的區域。當 DNMT3A2 作為 IEG 新誘導(當神經元被活化時)時,會發生許多新的胞嘧啶甲基化,大概發生在 DNMT3A2 的目標區域。 Oliviera等人[ 132 ]發現海馬體中 Dnmt3a2 的神經元活動誘導的 IEG 水準決定了形成長期記憶的能力。
大鼠在情境恐懼條件反射(CFC)後形成了長期聯想記憶。[ 135 ] Duke等人。[ 29 ]研究發現,大鼠接受 CFC 24 小時後,海馬神經元中 2,097 個基因(佔大鼠基因組中基因的 9.17%)發生了甲基化改變。當基因啟動子區域的CpG 位點出現新甲基化的胞嘧啶時,基因通常會受到抑制,而當出現新去甲基化的胞嘧啶時,基因可能會被活化。[ 136 ] CFC 後,有 1,048 個基因的 mRNA 表現降低,564 個基因的 mRNA 表現上調。同樣,當小鼠接受 CFC 治療時,一小時後小鼠大腦海馬區就會出現 675 個去甲基化基因和 613 個高甲基化基因。[ 137 ]然而,記憶並不會留在海馬體中,四、五週後,記憶會儲存在前扣帶皮質。[ 138 ]在對 CFC 後的小鼠進行的研究中,Halder 等人。[ 137 ]研究表明,CFC 四周後,前扣帶皮層中至少有 1,000 個差異甲基化基因和超過 1,000 個差異表達基因,而同時海馬中改變的甲基化被逆轉。
新記憶建立後,甲基化的表觀遺傳學改變會產生不同的核 mRNA 池。正如伯恩斯坦 (Bernstein) 所評論的[ 30 ] ,表觀遺傳決定的核mRNA的新混合物通常被包裝成神經元顆粒或信使 RNP,它由 mRNA、大小核醣體亞基、翻譯起始因子和調節 mRNA 功能的 RNA 結合蛋白組成。這些神經元顆粒從神經元細胞核運輸而來,並根據顆粒中 mRNA 的 3′ 非翻譯區(它們的「郵遞區號」)被引導至神經元樹突。大約 2,500 個 mRNA 可能位於海馬迴錐體神經元的樹突中,也許 450 個轉錄物位於興奮性突觸前神經末梢(樹突棘)中。改變的轉錄本種類(依賴神經元核中的表觀遺傳改變)對訊號有不同的敏感性,這是改變突觸可塑性的基礎。改變的突觸可塑性通常被認為是學習和記憶的神經化學基礎。
老化
表觀遺傳學在大腦老化和與年齡相關的認知能力下降中發揮重要作用,與延長壽命有關。[ 139 ] [ 140 ] [ 141 ] [ 142 ] [ 143 ]
其他及一般
在成年期,表觀基因組的變化對各種高階認知功能很重要。表觀遺傳機制的失調與神經退化性疾病和疾病有關。神經元的表觀遺傳修飾是動態的、可逆的。[ 144 ]表觀遺傳調控影響神經元活動,影響學習、記憶和其他認知過程。[ 145 ]
早期事件,包括胚胎發育過程中的事件,可以透過表觀遺傳機制影響發育、認知和健康結果。[ 146 ]
表觀遺傳機制被認為是「內源性荷爾蒙影響發育中大腦迴路組織的潛在分子機制」。[ 147 ]
營養素可以與表觀基因組相互作用,從而「保護或促進整個生命週期的認知過程」。[ 148 ] [ 149 ]
一篇評論表明,透過表觀遺傳學,體育鍛煉產生的神經生物學效應似乎“對於建立‘表觀遺傳記憶’以影響長期大腦功能和行為至關重要”,甚至可能是可遺傳的。[ 150 ]
透過軸纖毛突觸,血清素 軸突和CA1錐體神經元的觸角狀初級纖毛之間可以進行通訊,從而透過與質膜(和長期)不同的訊號傳導改變細胞核中神經元的表觀遺傳狀態。 [ 151 ] [ 152 ]
表觀遺傳學在人類大腦演化中也扮演著重要角色。[ 153 ]
發展
發育表觀遺傳學可分為預定表觀遺傳學和機率表觀遺傳學。預定的表觀遺傳是從 DNA 結構發育到蛋白質功能成熟的單向運動。這裡的「預定」是指發展是有腳本的、可預測的。另一方面,機率表觀遺傳是一種雙向的結構功能發展,具有經驗和外部成型發展。[ 154 ]
體細胞表觀遺傳,特別是透過 DNA 和組蛋白共價修飾和核小體重新定位,在多細胞真核生物的發育中非常重要。[ 124 ]基因組序列是靜態的(有一些顯著的例外),但細胞分化成許多不同類型,執行不同的功能,並對環境和細胞間信號做出不同的反應。因此,隨著個體的發育,形態發生素以表觀遺傳的方式活化或沉默基因,賦予細胞記憶。在哺乳動物中,大多數細胞終末分化,只有幹細胞保留分化成幾種細胞類型的能力(「全能性」和「多能性」)。在哺乳動物中,一些幹細胞在整個生命過程中不斷產生新分化的細胞,例如在神經發生過程中,但哺乳動物無法對某些組織的損失做出反應,例如無法再生肢體,而其他一些動物卻能夠做到這一點。表觀遺傳修飾調節從神經幹細胞到神經膠質祖細胞的轉變(例如,分化為少突膠質細胞受組蛋白的去乙醯化和甲基化調節)。[ 155 ]與動物不同,植物細胞不會進行終末分化,而是保持全能性,能夠產生新的植物個體。雖然植物確實利用了許多與動物相同的表觀遺傳機制,例如染色質重塑,但有人假設某些植物細胞不使用或不需要“細胞記憶”,而是使用來自環境和周圍細胞的位置信息來重置其基因表達模式,以確定它們的命運。[ 156 ]
表觀遺傳變化可能因環境暴露而發生 - 例如,母親飲食補充染料木黃酮(250 毫克/公斤)會引起表觀遺傳變化,影響刺豚鼠基因的表達,從而影響其皮毛顏色、體重和患癌症的傾向。[ 157 ] [ 158 ] [ 159 ]正在進行的研究重點是探討其他已知致畸劑(如糖尿病胚胎病)對甲基化特徵的影響。[ 160 ]
一項研究的有爭議的結果表明,創傷經歷可能會產生能夠傳遞給後代的表觀遺傳訊號。透過對老鼠進行腳部電擊的訓練,讓它們害怕櫻花的氣味。研究人員報告說,小鼠後代對這種特殊氣味的厭惡感增強了。[ 161 ] [ 162 ]他們認為,表觀遺傳學變化會增加基因表達,而不是 DNA 本身,而基因 M71 則控制著鼻子中一種氣味受體的功能,這種受體對櫻花氣味有特異性的反應。經過訓練的小鼠及其後代的大腦中發生了與嗅覺功能相關的身體變化。報告提出了一些批評,包括研究的統計能力低,證明存在一些不規範之處,例如報告結果有偏見。[ 163 ]由於樣本量的限制,即使存在某種效應,也有可能無法在統計學意義上得到證實。批評意見指出,如果遵循相同的方案,假設所聲稱的效果存在,那麼所有報告的實驗都會顯示出正面結果的機率僅為 0.4%。作者也沒有指出哪些老鼠是兄弟姊妹,而是將所有老鼠視為統計上獨立的。[ 164 ]最初的研究人員在論文附錄中指出了批評意見在計算中遺漏的負面結果,並承諾將來會追蹤哪些老鼠是兄弟姊妹。[ 165 ]
跨世代
表觀遺傳機制是細胞分化演化起源的必要組成部分。[ 166 ] [需要引用來驗證]雖然多細胞生物中的表觀遺傳學通常被認為是一種參與分化的機制,當生物體繁殖時表觀遺傳模式會“重置”,但已經觀察到一些跨代表觀遺傳現象(例如,在玉米中觀察到的副突變現象)。儘管這些多代表觀遺傳特徵中的大多數會在幾個世代的時間裡逐漸消失,但多代表觀遺傳學可能是進化和適應的另一個面向。如上所述,有些人將表觀遺傳學定義為可遺傳的。
隔離生殖系或魏斯曼屏障是動物所特有的,而表觀遺傳在植物和微生物中更為常見。Eva Jablonka、Marion J. Lamb和 Étienne Danchin 認為,這些影響可能需要增強現代綜合的標準概念框架,並呼籲擴展進化綜合。[ 167 ] [ 168 ] [ 169 ]其他演化生物學家,如約翰‧梅納德‧史密斯,將表觀遺傳納入群體遺傳學模型[ 170 ],或公開對擴展演化綜合持懷疑態度(麥可‧林奇)。[ 171 ]托馬斯·迪金斯和卡齊·拉赫曼指出,DNA甲基化和組蛋白修飾等表觀遺傳機制是在自然選擇控制下遺傳的,因此符合早期的“現代綜合理論”。[ 172 ]
表觀遺傳與傳統遺傳有兩個重要區別,對演化有重要影響:
在植物中,可遺傳的DNA甲基化突變發生的可能性比DNA突變高100,000倍。[ 175 ]表觀遺傳元素(例如PSI+系統)可以充當“權宜之計”,足以實現短期適應,使譜系存活足夠長的時間,以便發生突變和/或重組,從而從基因上吸收適應性表型變化。[ 176 ]這種可能性的存在增加了一個物種的 演化能力。
在原核生物、植物和動物等多種生物中,已通報了100多例跨代表觀遺傳現象。 [ 177 ]例如,哀悼斗篷蝴蝶會隨著溫度變化的實驗而改變荷爾蒙的顏色。[ 178 ]
絲狀真菌粗糙脈孢菌是了解胞嘧啶甲基化的控制和功能的突出模型系統。在該生物體中,DNA甲基化與稱為RIP(重複誘導點突變)的基因組防禦系統的殘餘有關,並透過抑制轉錄延伸來沉默基因表現。[ 179 ]
酵母朊病毒PSI是由翻譯終止因子的構象變化產生的,然後由子細胞遺傳。這可以在不利條件下提供生存優勢,體現了表觀遺傳調控使單細胞生物能夠快速應對環境壓力。朊病毒可被視為無需改變基因組就能誘導表型改變的表觀遺傳因子。[ 180 ]
利用單分子即時定序可以直接檢測微生物中的表觀遺傳標記,其中聚合酶敏感性允許在對 DNA 分子進行定序時測量甲基化和其他修飾。[ 181 ]多個項目已證明有能力收集細菌全基因組表觀遺傳學數據。[ 182 ] [ 183 ] [ 184 ] [ 185 ]
細菌的表觀遺傳學

雖然表觀遺傳學對於真核生物,特別是後生動物來說具有根本的重要性,但它在細菌中發揮不同的作用。[ 186 ]最重要的是,真核生物主要利用表觀遺傳機制來調節基因表達,而細菌很少這樣做。然而,細菌廣泛利用複製後 DNA 甲基化來表觀遺傳控制 DNA-蛋白質相互作用。細菌也使用 DNA腺嘌呤甲基化(而不是 DNA胞嘧啶甲基化)作為表觀遺傳訊號。 DNA腺嘌呤甲基化對大腸桿菌、沙門氏菌、弧菌、耶爾森氏菌、嗜血桿菌和布魯氏菌等細菌的毒性具有重要意義。在Alphaproteobacteria中,腺嘌呤甲基化調節細胞週期並將基因轉錄與 DNA 複製偶聯。在Gammaproteobacteria中,腺嘌呤甲基化為DNA複製、染色體分離、錯配修復、噬菌體包裝、轉座酶活性和基因表現調控提供訊號。[ 180 ] [ 187 ]肺炎鏈球菌(肺炎鏈球菌)中存在一個基因開關,可以讓這種細菌隨機改變其特性,變成六種替代狀態,這可能為改進疫苗鋪平道路。每種形式都是由相變甲基化系統隨機產生的。肺炎鏈球菌引起致命感染的能力在這六個州是不同的。其他細菌屬中也存在類似的系統。[ 188 ]在艱難梭菌等芽孢桿菌中,腺嘌呤甲基化調節孢子形成、生物膜形成和宿主適應性。[ 189 ]
藥物
表觀遺傳學具有多種多樣的潛在醫學應用。[ 190 ]
雙胞胎
同卵雙胞胎的直接比較構成了探究環境表觀遺傳學的最佳模式。對於處於不同環境暴露的人類來說,同卵雙胞胎在早年在表觀遺傳學上難以區分,而年齡較大的雙胞胎在 5-甲基胞嘧啶 DNA 和組蛋白乙醯化的總體含量和基因組分佈方面存在顯著差異。[ 10 ]一生中共同生活時間較短和/或病史差異較大的雙胞胎,其5-甲基胞嘧啶DNA 水準以及組蛋白H3 和 H4乙醯化水準差異最大。 [ 191 ]
異卵雙胞胎和同卵雙胞胎均顯示表觀遺傳影響人類的證據。[ 191 ] [ 192 ] [ 193 ]單例研究中大量的 DNA 序列差異不會幹擾分析。環境差異會產生長期的表觀遺傳效應,從表觀遺傳的角度來看,不同發育的同卵雙胞胎亞型在易感性上可能有所不同。[ 194 ]
一項高通量研究(指研究廣泛遺傳標記的技術)重點研究同卵雙胞胎之間的表觀遺傳差異,以比較40 對同卵雙胞胎樣本中DNA 甲基化和組蛋白修飾的整體和基因座特異性變化。 [ 191 ]本研究僅研究了健康的雙胞胎,但年齡範圍很廣,從 3 歲到 74 歲不等。這項研究的主要結論之一是,雙胞胎中的兩個兄弟姐妹之間存在著與年齡相關的表觀遺傳差異的累積。這種累積表明存在表觀遺傳「漂移」。表觀遺傳漂變是指表觀遺傳修飾,因為它們是與年齡直接相關的。雖然年齡是許多疾病的已知風險因素,但已發現與年齡相關的甲基化在基因組的特定位點上存在差異。隨著時間的推移,這會導致生物年齡和實際年齡之間出現可測量的差異。研究發現,表觀遺傳變化反映了生活方式,並可能在達到臨床閾值之前充當疾病的功能性生物標記。 [ 195 ]
最近的一項研究對 114 對同卵雙胞胎和 80 對異卵雙胞胎的約 6000 個獨特基因組區域的 DNA 甲基化狀態進行了分析,得出結論,胚泡分裂時的表觀遺傳相似性也可能導致同卵雙胞胎的表型相似性。這支持了以下觀點:胚胎發育早期的微環境對於表觀遺傳標記的建立非常重要。 [ 192 ]人們對先天性遺傳疾病有了很好的了解,表觀遺傳學顯然可以發揮作用,例如在安吉曼症候群和普拉德-威利症候群的病例中。這些是正常的遺傳疾病,由基因缺失或基因失活引起,但由於個體由於基因組印記而本質上是半合子,因此它們異常常見,因此單一基因敲除就足以導致疾病,而大多數情況下需要兩個拷貝都被敲除。[ 196 ]
基因組印跡
一些人類疾病與基因印記有關,這是哺乳動物中的一種現象,父親和母親對其生殖細胞中的特定基因組位點貢獻不同的表觀遺傳模式。[ 197 ]人類印跡疾病中最著名的案例是安傑爾曼症候群和普拉德威利症候群-這兩種疾病都可以由同一種基因突變引起,即15q 染色體部分缺失,而具體發展成哪種綜合徵取決於這種突變是從孩子的母親那裡遺傳的,還是從父親那裡遺傳的。[ 198 ]
在Överkalix的研究中,瑞典男性的孫子(而不是外孫)[ 199 ]在青春期前經歷過19世紀的飢荒,死於心血管疾病的可能性較小。如果食物充足,那麼孫輩的糖尿病死亡率就會增加,這表明這是一種跨代表觀遺傳。 [ 200 ]在女性中觀察到了相反的效果——在子宮內(因此在卵子形成時)經歷過飢荒的婦女的孫女(而不是母系孫女)平均壽命較短。[ 201 ]
藥物改變表觀遺傳事件基因表現的例子
使用β-內醯胺類抗生素可以改變麩胺酸受體活性和環孢菌素對多種轉錄因子的作用。此外,鋰可以影響異常蛋白質的自噬,而長期使用鴉片類藥物可以增加與成癮表型相關的基因的表達。[ 202 ]
父母的營養狀況、子宮內暴露於壓力或內分泌幹擾化學物質[ 203 ]、男性誘發的母體效應(如差異配偶質量的吸引力)、母親和父親的年齡以及後代的性別,都可能影響種系表觀突變最終是否在後代中表現出來,以及代際遺傳在後代中保持穩定的程度。[ 204 ]然而,表觀遺傳效應是否能夠跨代傳遞、以及在多大程度上跨代傳遞仍不清楚,尤其是在人類中。[ 205 ] [ 206 ]
癮
成癮是大腦獎勵系統的一種障礙,它透過轉錄和神經表觀遺傳機制產生,並且由於長期高水平接觸成癮刺激(例如嗎啡、可卡因、性交、賭博)而發生。[ 207 ] [ 208 ] [ 209 ]臨床前研究表明,成癮表型存在跨代表觀遺傳。 [ 210 ] [ 211 ]然而,在人類中尚未找到強有力的證據支持表觀遺傳效應能夠跨代持續存在;例如,在胎兒時期接觸吸煙的表觀遺傳效應可以在未接觸過吸煙的曾孫身上觀察到。[ 205 ]
研究
遺傳訊息有兩種形式,即遺傳和表觀遺傳,統稱為雙重遺傳。胞嘧啶脫氨酶的 APOBEC/AID 家族成員可能使用相似的分子機制同時影響遺傳和表觀遺傳,並且可能是這些概念上分隔的過程之間的串擾點。[ 212 ]
氟喹諾酮類抗生素透過鐵螯合作用誘導哺乳動物細胞的表觀遺傳學變化。這透過抑制需要鐵作為輔因子的 α-酮戊二酸依賴性雙加氧酶產生表觀遺傳效應。 [ 213 ]
各種藥物均可用於產生誘導多能幹細胞 (iPSC) 或透過表觀遺傳方法維持胚胎幹細胞 (ESC) 表現型。成體幹細胞(如骨髓幹細胞)在 G9a 組蛋白甲基轉移酶抑制劑 BIX01294 處理時也顯示出分化為心臟活性細胞的潛力。[ 214 ] [ 215 ]
細胞可塑性是細胞在不改變遺傳密碼的情況下對刺激的適應,需要表觀遺傳學改變。在癌細胞上皮-間質轉化過程中的細胞可塑性中已經觀察到了這些現象[ 216 ],在免疫細胞(如巨噬細胞)中也觀察到了這些現象。[ 217 ]有趣的是,代謝變化是這些適應的基礎,因為各種代謝物在表觀遺傳標記的化學反應中發揮著至關重要的作用。例如,這包括組蛋白去甲基化所需的α-酮戊二酸和組蛋白乙醯化所需的乙醯輔酶A。
表觀基因組編輯
可以改變或用於表觀基因組編輯的基因表現的表觀遺傳調控包括mRNA/lncRNA 修飾、DNA 甲基化修飾和組蛋白修飾。[ 218 ] [ 219 ] [ 220 ]
CpG 位點、SNP 和生物學性狀
甲基化是一種廣泛被鑑定的遺傳調控機制,可以決定生物性狀。然而,強有力的實驗證據表明 SNP 中的甲基化模式是經典活化/抑製表觀遺傳教條的一個重要的附加特徵。共定位分析支持的分子交互作用數據識別出多種核調控途徑,將序列變異與 DNA 甲基化紊亂以及分子和表型變異聯繫起來。[ 221 ]
UBASH3B基因座
UBASH3B編碼一種具有酪胺酸磷酸酶活性的蛋白質,該蛋白質先前已被證明與晚期腫瘤有關。[ 222 ] SNP rs7115089 被確定為影響該基因座的 DNA 甲基化和表達,以及身體質量指數 (BMI)。[ 221 ]事實上,SNP rs7115089 與 BMI 密切相關[ 223 ],並且在 GWAS 中與其他心血管和代謝性狀相關的遺傳變異也密切相關。[ 224 ] [ 225 ] [ 226 ]新的研究顯示UBASH3B是肥胖和心臟代謝疾病的潛在媒介。[ 221 ]此外,動物模型表明,UBASH3B表達是熱量限制的指標,可能驅動程序性肥胖易感性,並且與人類外周血中其他肥胖指標相關。[ 227 ]
NFKBIE基因座
SNP rs730775 位於NFKBIE的第一個內含子上,是全血中NFKBIE的順式eQTL 。 [ 221 ]核因子 (NF)-κB 抑制劑 ε (NFKBIE) 直接抑制 NF-κB1 活性,並與 NF-κB1 顯著共表達,並且與類風濕性關節炎有關。[ 228 ]共定位分析支持 SNP rs730775 中大多數 CpG 位點的變異導致NFKBIE基因座的遺傳變異,這可能透過NF-κB 對 DNA 甲基化的反式調控與類風濕性關節炎有關。 [ 221 ]
FADS1基因座
脂肪酸去飽和酶1(FADS1)是脂肪酸代謝的關鍵酵素。[ 229 ]此外, FADS1基因中的 rs174548與 CD8+ T 細胞豐富度高的族群的 DNA 甲基化相關性增強。[ 221 ] SNP rs174548 與脂肪酸代謝的花生四烯酸和其他代謝物的濃度、[ 230 ] [ 231 ]血液嗜酸性粒細胞計數密切相關。[ 232 ]以及氣喘等發炎性疾病。[ 233 ]交互作用結果顯示 rs174548 與氣喘之間存在相關性,為具有免疫表型的 CD8+ T 細胞中的脂肪酸代謝提供了新的見解。[ 221 ]
參見
表觀遺傳學[1][2](英語:epigenetics)又譯表徵遺傳學、表遺傳學(舊譯名有擬遺傳學、外遺傳學、後遺傳學等),屬於生物學和遺傳學的分支學科,其研究範疇為:在「非DNA序列變化」情況下,遺傳信息通過某些機制或途徑傳遞給子代[3]。

表觀遺傳現象的機制或途徑,包括DNA甲基化、RNA甲基化、RNA干擾、核小體定位、染色質構象改變、染色質重塑、組蛋白修飾,長非編碼RNA序列等。與經典遺傳學以研究基因序列影響生物學功能為核心相比,表觀遺傳學主要研究這些「表觀遺傳現象」建立和維持的機制。其研究內容主要包括兩類,一類為基因選擇性轉錄表達的調控,有DNA甲基化、基因印記、組蛋白共價修飾和染色質重塑;另一類為基因轉錄後的調控,包括基因組中非編碼RNA、微小RNA、反義RNA、內含子及核糖開關等。
表觀遺傳學是1980年代逐漸興起的一門學科,是在研究與經典的孟德爾遺傳學遺傳法則不相符的許多生命現象過程中逐步發展起來的。
表觀遺傳學研究的是:基因組相關功能改變而不涉及核苷酸序列變化。例如DNA甲基化和組蛋白修飾,兩者均能在不改變DNA序列的前提下調節基因的表達;阻遏蛋白通過結合沉默基因區域從而控制基因的表達。這些變化可能通過細胞分裂而得以保留,並且可能持續幾代。這些變化都僅是非基因因素導致的生物體基因表現(或「自我表達」)的不同[4],由於目前尚不清楚組蛋白的化學修飾是否可遺傳,有人對於用此術語描述組蛋白化學修飾提出了異議[5][6]。
表觀遺傳學在真核生物中主要表現在細胞分化過程。在形態發生過程中,全能幹細胞將分化成完全不同的細胞,也就是說,一個受精卵分化出各種不同類型的細胞,包括神經細胞、肌肉細胞、上皮細胞、血管內皮細胞等,並通過抑制其他細胞和激活相關基因而進行持續的細胞分裂[7]。
2011年的相關研究已證實,mRNA甲基化對人體內能量平衡發揮著至關重要的作用,對RNA上的N6-甲基腺苷苷進行脫甲基化可控制FTO基因相關肥胖症,並因此而開創了RNA表觀遺傳學的相關領域[8][9]。
詞源和定義
由於表觀遺傳學定義有多種,導致了在表觀遺傳學代表什麼這一問題上出現了分歧。表觀遺傳學由C.H.沃丁頓於1942年作為後生論和遺傳學的合詞而提出[10]。
後生論是一個很古老的概念[11],現在更多的用於描述胚胎發育過程中的細胞分化源自幹細胞的全能性。當沃丁頓提出這一詞語時,人們對基因的物理性質及其在遺傳中的作用還不清楚,使用該詞語是表示,基因可能與環境相互作用,並產生表現型的概念。Robin Holliday將表觀遺傳學定義為「在複雜有機體的發育過程中,對基因活性在時間和空間中調控機制的研究」[12]。因此,後生論也可用於描述任何影響有機體發育的因素,而不僅僅是DNA序列。
現在科學界對表觀遺傳學有了更嚴格的定義。Arthur Riggs及其同事將其定義為,有關引起可遺傳的基因功能改變的有絲分裂和/或減數分裂的研究,這些變化以DNA序列改變無法解釋[13]。表觀遺傳學的希臘語前綴epi-意味著「在…之上」或「除…之外」,因此表觀遺傳學的特徵是傳統的分子水平遺傳之上或之外的遺傳。
「表觀遺傳學」也被用於描述還未證實的組蛋白修飾的遺傳過程,因此可嘗試用更廣義的術語來重新定義。例如,阿德里安·伯德將表觀遺傳學定義為,染色體的構造適應,以便啟始、發出信號或保持變構的活性狀態[14]。這個定義既包括涉及DNA修復或細胞周期的瞬態改變,也包括多代細胞的穩態改變,但是不包含細胞膜結構和朊病毒,除非其影響到染色體功能。但這樣的定義並不被普遍接受並仍然受到爭議[15]
2008年的冷泉港會議達成了關於表觀遺傳學的共識,即「由染色體改變所引起的穩定的可遺傳的表現型,而非DNA序列的改變」[16]。
與「遺傳學」相似的詞衍生出很多平行的用法。「表觀基因組」是「基因組」的平行詞,指的是一個細胞的整體表觀遺傳狀態。「遺傳密碼」與「表觀遺傳密碼」對應,用於描述不同細胞產生不同表現型的一系列表觀遺傳特徵。「表觀遺傳密碼」可代表細胞的總體狀態,按每個分子在表觀遺傳地圖上所占的位置,可得出DNA甲基化和組蛋白修飾狀態的特定基因組區域的基因表達圖表。更典型的是,這個詞用於提及和評估特定的系統性措施,如組蛋白編碼或DNA甲基化模型相關的表觀遺傳學形式。
心理學家Erik Erikson在其著作中提到「後生論」,認為後生規則是「任何生長的事物都有一個平面圖,在這個圖之外各個部分先後出現,而每個部分都有其特定的優勢期,直至所有的部分出現從而形成一個功能整體。」[17]個用法有一定的歷史價值[18]。
表觀遺傳學的分子基礎
表觀遺傳的改變可以導致特定基因的激活,而不必改變DNA序列。此外,染色質蛋白與DNA相關聯可能被激活或沉默。這是不同的細胞在多細胞有機體中只表達其活動必需基因的原因。當細胞進行分裂時,表觀遺傳的變化得以保存。
大多數表觀遺傳變化只發生在生物個體的一生中,但是,如果形成受精卵的精子或卵細胞發生了基因失活,那麼這種表觀遺傳變化將被傳遞給下一代[19]。由此拉馬克學說提出了一個問題:這種生物體表觀遺傳的變化是否可改變DNA的基本結構。
特殊的表觀遺傳過程包括副突變、書籤、基因組銘印、基因沉默、X染色體去活化、位置效應、重構、縮並、母體效應、致癌過程、致畸劑影響、組織蛋白修飾及異染色質的調控,最後是受技術局限的單性生殖及克隆。
DNA損傷也會導致表觀遺傳變化[20][21][22]。DNA損傷發生頻繁,人體平均每天會發生10000次。這些損傷大部分被修復,但在DNA修復時仍然可能發生表觀遺傳變化[[23]。尤其是雙鏈DNA的斷裂可能會引起未編程的表觀遺傳基因沉默,導致DNA甲基化和促進沉默蛋白質組的修飾(染色質重構)[24]。此外,多聚二磷酸腺苷核糖酶(Parp1酶)及其產物多聚二磷酸腺苷核糖(PAR)在修復過程中會積聚DNA的損傷[25]。這種累積,反過來,直接補充和激活染色質重塑蛋白ALC1進而導致核小體的重構[26]。而核小體的重構會導致DNA修復基因MLH1的沉默[27]。能造成DNA損傷的化學物質,如苯、對苯二酚、苯乙烯、四氯化碳和三氯乙烯,可通過激活氧化應激通路導致大量的DNA低甲基化[28]。
不同飲食影響老鼠表觀遺傳變化[27]。一些食物成分可增加DNA修復酶、MGMT、MLH1[29]和p53[30]和p53 [31][32])的水平,另一些食物成分如大豆異黃酮[33][34]和花青素[35]降低DNA損傷。
表觀遺傳研究廣泛使用分子生物學技術,如染色質免疫沉澱、螢光原位雜交法、甲基化敏感限制酶、DNA腺嘌呤甲基轉移酶識別、亞硫酸鹽定序等,從而幫助人們更深入地理解表觀遺傳現象。此外,生物信息學也發揮著越來越重要的作用(計算表觀遺傳學)。計算機模擬和分子動力學方法揭示了原子運動與組蛋白尾端變構分子的識別有關.[36]。
機制
一些類型的表觀遺傳系統在細胞記憶中可能扮演重要角色[37],然而需注意的是,並不是所有的表觀遺傳學例子都能被普遍接受。
DNA甲基化和染色質重構

細胞核個體的表現型受到自身基因轉錄的影響,因此可遺傳的轉錄能提高表觀遺傳效應。基因表達分多層調控,基因調控的一種途徑是通過染色質重構。染色質是DNA和組蛋白結合的複合體,DNA纏繞著組蛋白球體,若DNA纏繞組蛋白的方式發生改變,基因表達也將改變。染色質重構通過以下兩個主要機制完成:
- 第一條途徑是組成組蛋白的胺基酸的平移修改。組蛋白由長鏈胺基酸構成,如果鏈中的胺基酸改變,組蛋白的形態將發生改變。複製期間的DNA並非完全解鏈,因此,經過修改的組蛋白可能被用於每個新複製的DNA,這些組蛋白將作為模板,以新的方式合成新形態的組蛋白。通過改變周圍蛋白的形態,這些修改的組蛋白將確保分化的細胞保持分化狀態,而不是重新回到幹細胞狀態。
- 第二條途徑是通過增加位於CpG島上的DNA的甲基,使胞嘧啶轉化為5-甲基胞嘧啶。5-甲基胞嘧啶同正常的胞嘧啶一樣與鳥嘌呤配對,然而,基因組某些區域的甲基化較多,甲基化較高的區域通過不完全清楚的機制使得轉錄的活力減小。甲基化的胞核嘧啶也可以從父母一方的生殖細胞保留在受精卵中,標記染色體遺傳自雙親(遺傳印記)。
細胞分化過程中DNA甲基化將導致組蛋白性狀的變化。某些酶(如DNMT1 )對甲基化胞嘧啶有較高的親和力。如果這種酶達到DNA的「半甲基化」部分(兩條DNA鏈中只有一個甲基胞嘧啶),這種酶將催化另一部分。
雖然組蛋白修飾發生在整個序列中,非結構化的N-末端的蛋白(稱為組蛋白尾端)特別容易被修改。這些修改包括乙醯化,甲基化,泛素化,磷酸化和修飾作用。乙醯化是這些修飾中研究得最多的。例如,組蛋白H3尾部的K14和K9賴氨酸被組蛋白乙醯轉移酶(HATs)乙醯化通常與轉錄能力有關。
有人認為這種與「激活的」轉錄有關的乙醯化傾向於是一種生物物理學改變。因為通常在組蛋白末端有一個帶正電荷的氮,賴氨酸可以與DNA主鏈帶負電荷的磷酸鹽結合。乙醯化使側鏈上帶正電荷的氨基團變成中性的醯胺鍵。正電荷的去除,使DNA從組蛋白上解開。這時,SWI/SNF和其他轉錄因子複合體就可以結合到DNA上使轉錄開始。這是表觀遺傳作用的「順式」模型。就是說,組蛋白尾部改變對於DNA本身有一種直接效應。
另一種表觀遺傳作用模型是「反式」模型。在這個模型中,組蛋白尾部改變對DNA起間接作用。例如,賴氨酸乙醯化可以為染色質修飾酶(和基礎轉錄裝置)產生一個結合位點,然後該染色質重構體導致染色質狀態改變。實際上,布羅莫結構域——一個特異性與乙醯-賴氨酸結合的蛋白片段(域)——發現其幫助很多酶激活轉錄,包括SWI/SNF複合體(在polybromo蛋白上)。乙醯化可能作用於此和之前的途徑而幫助轉錄激活。
組蛋白甲基化也證實了由相關因素導致的對接模塊作為一種修飾方式的推斷。組蛋白H3賴氨酸9的甲基化與組成型轉錄沉默染色質(組成型異染色質)有關。已確定轉錄阻遏蛋白HP1的一個染色質域(特異性結合甲基-賴氨酸的域)在HP1到K9的甲基化區域發揮作用。而一個看起來像反駁甲基化的生物物理學模型,賴氨酸4上的組蛋白H3的三甲基化與轉錄激活強相關(且完全需要)。三甲基化將在組蛋白尾部引進一個固定正電荷。
已研究證明,組蛋白賴氨酸轉甲基酶(KMT)在組蛋白H3和H4模式中負責甲基化激活。該酶利用一個叫SET域(Suppressor of variegation,zeste增強子,Trithorax)的催化活性位點。SET域是一個130個胺基酸的序列,參與調控基因活化。已證實其可與組蛋白尾部結合,導致組蛋白甲基化。[38]
不同的組蛋白修飾可能通過不同的方式起作用;一個位置的乙醯化可能比另一個位置的乙醯化發揮更加不同的作用。另外,同時可以發生多重修飾,這些修飾可以一起工作來改變核小體的行為。多重動態修飾以一種系統的和可繁殖的方式調節基因轉錄叫做組蛋白密碼。
DNA甲基化
DNA甲基化頻繁發生於重複序列,幫助抑制表達和「轉座子」的流動性::[39]由於5-甲基胞嘧啶可以自發脫氨基(用氧替代氮)變成胸苷,除了CpG島保持未甲基化外,CpG位點經常發生變化,其在基因組中逐漸變得稀少,。因此這種類型的表觀遺傳改變具有直接增加永久的基因突變頻率的潛力。已知DNA甲基化通過至少三個獨立的DNA甲基轉移酶的複雜的相互作用而對環境因子做出反應,從而使其得以建立和修改,DNMT1,DNMT3A和DNMT3B,其中任何一個缺失對於小鼠都是致命的。DNMT1在體細胞中是最多的轉甲基酶,[40][41]局限在複製中心。[42]對於半甲基化的DNA具有10-40倍的優先權,並與增殖細胞核抗原(PCNA)發生相互作用。[43]
通過優先修飾半甲基化的DNA,DNMT1在DNA複製後將甲基化模式轉移給一條新的合成鏈,因此經常作為「維持」甲基轉移酶被提及。[44]DNMT1對於適當的胚胎發育、印刻銘記和X失活是必需的。[45][46]為了強調這個遺傳分子機制與權威的瓦特生-克里克遺傳信息的鹼基配對遺傳機制的區別,引進了「表觀遺傳模板」這個術語。[47]此外,除了維持和傳送甲基化DNA狀態,相同的原理也能作用於保持和傳送組蛋白修飾,甚至細胞質(結構上)的遺傳狀態。[48]
在無脊椎動物研究里,以蜜蜂為模型,研究表明DNA甲基化影響蜜蜂基因組的替代剪切機理,從而影響基因的調節[49]。2020 發表的研究還表明受病毒感染的蜜蜂蛹的DNA甲基化會影響和調節免疫基因的表達。 [50] 很多綜述也總結了DNA甲基化在社會性昆蟲的分子機制和功能。 [51] [52]
RNA甲基化
RNA甲基化(RNA methylation)是指在RNA分子中添加一個甲基基團的修飾過程,主要包括N6-甲基腺嘌呤(N6-methyladenosine,m6A)修飾。這種修飾在近年來引起了廣泛關注,因為它在基因表達和細胞過程中具有調控作用。有研究表明RNA甲基化和蜜蜂的攻擊行為有關,而且是通過改變父系或母系基因的RNA甲基化。 [53]
組蛋白修飾
組蛋白H3和H4也能利用組蛋白賴氨酸脫甲基酶(KDM),通過反甲基化而調節。這個最近被確認的酶有一個叫Jumonji域(JmjC)的催化活性位點。當JmjC使用多個輔助因子使甲基團羥基化時,發生了反甲基化,由此除去甲基。JmjC能夠對單、雙和三甲基化底物進行脫甲基。[54]
染色體區域能夠採用穩定的和可遺傳的二選一的狀態導致無DNA序列變化的雙穩態的基因表達。表觀遺傳控制經常與非正統的組蛋白共價修飾有關。[55]的染色體區域的穩定性和遺傳性狀態經常被認為包含正反饋,在那裡被修飾的核小體動員酶對附近的核小體進行類似的修飾。這一發現證實了表觀遺傳學的一種簡化隨機模型。[56][57]
由於DNA甲基化和染色質重塑在很多表觀遺傳類型中發揮著核心作用,「表觀遺傳」這個詞有時被用來作為這些過程的一個同義詞。然而,這可能是有誤導性。染色質重塑不一定遺傳,而且不是所有的表觀遺傳都包括染色質重塑。[58]
有人認為組蛋白密碼能夠被小RNA的作用所調節。最近發現和界定的一種大量的小的(21-到26-nt)非編碼RNA,提示有一種RNA組分可能參與表觀基因調控。小干擾RNA能通過靶啟動子的表觀遺傳調節來調節轉錄基因表達。[59]
RNA轉錄本及其編碼蛋白
有時,一個基因被發動後轉錄成保持該基因活性的產物(直接或間接)。例如,Hnf4和MyoD通過編碼蛋白的轉錄因子活性而分別加強很多肝臟和肌肉特異性基因的轉錄,包括它們自己的轉錄。RNA信號傳輸包括有區別的募集同層次的一般染色質修飾複合體和在分化及發展中通過RNA使DNA轉甲基酶到特定的位點。[60]其他表觀遺傳變異由RNA不同粘接形式的產物或雙鏈RNA(RNAi)的形成來介導。即使基因活化的原始刺激已經不存在,基因被發動的細胞的後代也將繼承這種活性。這些基因對一些系統合胞體或縫隙連接很重要,常常被信號轉導打開或關閉,,RNA可以通過擴散直接傳播到其他細胞或細胞核中。大量RNA和蛋白通過母親卵子形成過程或通過足細胞促成受精卵,導致母體效應的表型。少量精子RNA來自於父親,但最近證明該表觀遺傳信息能導致幾代後代的明顯改變。[61]
微RNA
微RNA(miRNA)是非編碼RNA的成員,大小範圍從17到25個核苷酸。正如王等研究的,[62]微RNA調節植物和動物各種各樣的生物功能。迄今為止,2013年在人類中以發現大約有2000種微RNA,都可以在在線微RNA資料庫中找到。[63]在細胞中表達的每一種微RNA可靶向約100到200種由其下調的信使RNA。[64]多數信使RNA的下調通過靶向信使,使RNA發生衰退,另一些下調發生在翻譯成蛋白的水平。[65]
大約60%的人類蛋白編碼基因由微RNA調節。[66]很多微RNA由表觀遺傳調控。約50%的微RNA基因與CpG島有關,[62]其可能被表觀遺傳甲基化抑制。來自甲基化的CpG島的轉錄被強烈抑制並可遺傳。[67]其他微RNA通過組蛋白修飾或通過DNA甲基化和組蛋白修飾組合來進行表觀遺傳調節。[62]
小RNA
小RNA是在細菌中發現的小的(50-250的核苷酸),高度結構化的,非編碼的RNA片段。小RNA控制基因表達,包括病原體毒力基因,並被認為是與細菌耐藥性作鬥爭的新靶點。[68]小RNA在很多生物進程中發揮重要作用,與原核生物靶向信使RNA和蛋白結合。對小RNA的系統發育分析,例如通過小RNA-信使RNA靶向互動或蛋白結合特性,可建立綜合資料庫。[69]同時也建立了與微生物基因組的目標相關的小RNA-基因圖譜。[70]
長非編碼RNA序列
大量研究表明,長鏈非編碼 RNA (lncRNA) 在基因表達和染色體修飾的調節中發揮著關鍵作用,從而對細胞分化發揮重要控制作用。這些長非編碼 RNA 也有助於基因組印記和 X 染色體失活。 [71] 在蜜蜂群居昆蟲等無脊椎動物中,長非編碼 RNA 被檢測為一種可能的表觀遺傳機制,通過等位特異性基因(來自父系或母系)決定攻擊行為。[72]
朊毒體
朊毒體是蛋白質有傳染性的部分。通常,蛋白質摺疊成執行不同細胞功能的不相關的單元,但有些蛋白質也能形成有傳染性的構象狀態,如已知的感染性蛋白質。雖然曾經認為朊毒體具備將相同蛋白質的其他原生狀態催化轉變為一種有傳染性構象狀態的能力,但在以後的研究中,又認為其是表觀遺傳的代理,具有不修飾基因組而引起表型改變的能力。[73]
真菌朊毒體被認為具有表觀遺傳,原因是由感染性蛋白質引起的感染性表型能夠不修飾基因組而遺傳。1965年和1971年在酵母菌中發現的PSI+和URE3,是這種感染性蛋白質中研究最為充分的兩個。[74][75]朊毒體可以通過抑制表型效應蛋白的聚集,從而降低蛋白質的活性。在PSI +細胞,Sup35蛋白質的損失(參與翻譯終止)導致核糖體終止密碼子翻譯率更高,抑制其他基因中無意義突變。Sup35形成朊毒體的能力可能一直存在。它可以賦予細胞適應性優勢,使之能夠切換到PSI+狀態,表達休眠基因,而通常,這些特性被終止密碼子突變所抑制。[76][77][78][79]
結構遺傳系統
在纖毛蟲像是四膜蟲和草履蟲中,基因完全相同的細胞在其表面有著不同且可遺傳的纖毛紋,以實驗改變的纖毛紋可傳給子代,似乎存在一種結構起到模板的作用,這種遺傳機制尚未清楚,但有理由假設多細胞生物也會利用現存的細胞結構來組裝個新的。[80][81][82]
功能和影響
發育
體細胞表觀遺傳通過表觀遺傳修飾,特別是通過DNA甲基化和染色質重塑,在多細胞真核生物的發育中非常重要。基因組序列不變(有一些值得注意的例外),但細胞區分為很多不同的類型,執行不同的功能,對環境和細胞間的信號做出不同的反應。因此,作為個體發育,成形素激活或抑制在一種表觀遺傳方式里的沉默基因,賦予細胞一個「記憶」。在哺乳動物中,多數細胞終末分化,僅幹細胞保留分化成幾種細胞類型的能力(「全能性」和「多潛能性」)。在哺乳動物中,一些幹細胞在整個生命中持續產生新分化的細胞,但哺乳動物不能對一些組織的失去做出反應,例如,不能再生肢體,而其他一些動物可以。不像動物,植物細胞不終末分化而保持全能,具有產生一個新植物個體的能力。雖然植物像動物一樣利用很多相同的表觀遺傳機制,例如染色質重塑,已有假說認為一些種類的植物細胞不使用或不要求「細胞記憶」,而用來自環境和周圍細胞的位置信息重新設置其基因表達方式來決定其命運。[83]
表觀遺傳可分為預定的和基於概率的。預定的表觀遺傳是一種從DNA的結構性發展到蛋白質的功能成熟的單向運動。「預定」在這裡指發展是照本宣科和可預見的。另一方面,基於概率的表觀遺傳是一種隨著經歷和外部造型的發展的雙向結構-功能發育。[84]
跨代
醫學
表觀遺傳有各種各樣的潛在的醫學上的應用,同時它在世界上也趨向多面性。[85]先天性遺傳性疾病很好理解,表觀遺傳能夠發揮作用也很清楚,例如天使人症候群和普瑞德威利症候群。這些疾病像一般的遺傳疾病一樣由基因缺失或基因失活導致。但是由於基因組銘印的關係,個體本質上是半合子,因此敲除單個基因即足以致病,不像其它的遺傳疾病需要兩個拷貝都被敲除,所以這些疾病特別容易發生。[86]
演化
當表觀遺傳改變可遺傳時,表觀遺傳可影響演化。一個隔離的種系或魏斯曼屏障對於動物是特異的,表觀遺傳在植物和微生物中更為普遍。Eva Jablonka和Marion Lamb已經爭論過這些作用,認為可能需要推進現代綜合進化論標準的概念框架。[87][88]其他進化生物學家則建議結合表觀遺傳與群體遺傳學模型[89]或表示公開懷疑。[90]
表觀遺傳有兩個重要方式,可與傳統遺傳相區別,對於演化有重要的作用,這就是表突變率比一般突變率快得多[91]及表突變更容易逆轉。[92]種表觀遺傳要素,如PSI陽性系統可充當「臨時替代者」,由於短期適應足夠好,使得此血統存活足夠長,直到突變和/或複合以遺傳同化適應性的表型改變。[82] [93]這種存在可能增強一個物種的演化力。
樣本
觀遺傳改變已被觀察到在對環境暴露產生反應時發生,例如,給予膳食補充劑的小鼠具有影響基因表達的表觀遺傳改變,影響其毛色,體重和患癌症的傾向。[94][95]
就人類在不同環境暴露下來說,Fraga等研究年輕的和年老的同卵雙胞胎。發現儘管這些雙胞胎在早年很難從表觀遺傳上區分,但老年雙胞胎在5-甲基胞嘧啶DNA和組蛋白乙醯化的整體含量及基因組分布上具有顯著差異。共度時間較短的雙胞胎和/或醫療史差異較大的雙胞胎在5甲基胞嘧啶DNA和組蛋白H3及H4乙醯化水平差異也更大。
在廣泛的有機體範圍內,包括原核生物,植物和動物,已有超過100種的跨代的表觀遺傳現象被報道。[96]
最近的分析提示,胞嘧啶脫氨酶APOBEC/AID家族的成員能夠利用類似的分子機制同時調節基因的和表觀的遺傳。[97]
人類的表觀遺傳效應
基因組印跡和相關疾病
一些人類疾病與基因組印記有關,在哺乳動物中有一種現象,即父親和母親在其生殖細胞中對特定的染色體組位點貢獻不同的表觀遺傳模式。[98]在人類疾病中眾所周知的印記案例是Angelman症候群和普拉德-威利症候群——兩者可由相同的基因突變產生,染色體15q部分缺失,這個特別的症候群將依賴於突變是繼承於母親還是父親而發展。[99]原因是在這個區域裡存在基因組印記。
Beckwith-Wiedemann症候群也與基因組印記有關,經常由母體基因組印記的染色體11上的一個區域異常導致。
跨代表觀遺傳觀察
在Överkalix研究中,馬庫斯·彭布雷等[100]觀察到,在19世紀,瑞典男子如在青春期前遭受營養不良,則其孫子可能較少死於心血管疾病。如果這些男子的食物豐富,那其孫子的糖尿病死亡率就增加,提示這是一種跨代的表觀遺傳。[101]在女性中觀察到相反的效應——如女子在在子宮內經歷過營養不良(且其卵子正在形成),則其孫女的平均壽命短一些。[102]
表觀遺傳與發育異常
很多致畸劑通過表觀遺傳機制對胎兒發揮特定作用。[103][104]表觀遺傳效應可以保持致畸劑的作用,如己烯雌酚可以影響兒童的整個生命周期,但由父親暴露引起後代出生缺陷的可能性因為缺乏理論基礎而不能成立。[105]然而,一系列由男性介導的異常已被證實,如阿扎胞苷[106] ,FDA規定,當使用5-阿扎胞苷(當其整合進入DNA後形成低甲基化胞苷成為不可甲基化類似物的物質)時,「男性應注意避孕」。證據是:5-阿扎胞苷處理過的雄性小鼠繁殖力下降,增加了胚胎丟失和異常胚胎發育的機會。[107]在暴露於嗎啡的雄性大鼠的後代中觀察到內分泌差異。[108]在小鼠中,己烯雌酚的第二代效應已被描述為是通過表觀遺傳機制而發生的。[109]
除了形成受精卵的卵子和精子的基因發生表觀遺傳變化會傳遞給下一代外,正在發育的胎兒在宮內也會因為母親暴露於某些因素而發生表觀遺傳變化。很多流行病學調查顯示,胎兒在宮內的生長發育狀況與某些成人疾病的發生存在一定的關係。如Barker著名的「成人疾病胎兒起源」假說。該假說認為,胎兒在孕中晚期營養不良,會引起生長發育失調,且成年後易患冠心病。與低出生體重相關的疾病還包括動脈粥樣硬化、冠心病、2型糖尿病等。
表觀遺傳與癌症
多種複合物被認為是表觀遺傳致癌物——導致腫瘤發生率增加,但不顯示誘變活性(有毒複合物和導致腫瘤發生或復發的病原體應該被排除)。實例包括己烯雌酚,亞砷酸鹽,六氯苯和鎳複合物。最近的研究已顯示,系白血病(MLL)基因通過在不同染色體中重排和接合其他基因導致白血病,是一個在表觀遺傳控制下的過程。[110]
其他研究證實,在許多基因中發生的組蛋白乙醯化改變和DNA甲基化對前列腺癌起作用。[111]前列腺癌的基因表達可被營養和生活方式改變所調節。[112]
2008年國家衛生研究院宣布,在接下來的5年中將投資1.9億美元用於表觀遺傳研究。在宣告書中,政府注意到表觀遺傳具有解釋老化機制,人類發育和癌症起源,心臟病,精神疾病及其他的健康狀況的潛力。一些研究者,如杜克大學醫學中心博士蘭迪·朱特爾認為,在疾病治療方面,對於以上疾病,表觀遺傳學研究可能比遺傳學具有更大的作用。[113]
在癌症中的DNA甲基化
DNA甲基化是一種基因轉錄的重要的調節器,許多證據已經證實,異常的DNA甲基化與不定期的基因沉默有關,若在啟動子區域具有高水平的5-甲基胞嘧啶,將發生基因沉默。DNA甲基化在胚胎發育期間是必需的,在體細胞中,DNA甲基化的方式通常是高保真的傳給子細胞。異常的DNA甲基化模式與大量的人類惡性腫瘤有關,並發現其與正常組織相比存在兩種不尋常的形式:超甲基化和低甲基化。超甲基化是主要的表觀遺傳修飾中的一種,其通過腫瘤抑制基因的啟動子區抑制轉錄。超甲基化通常發生在啟動子區的CpG島,且與基因失活有關。整體的低甲基化也通過不同機制與癌症的發生和發展有關。[114]
在癌症中的DNA修復表觀遺傳學
種系(家族的)突變已在34種導致癌症高風險的不同的DNA修復基因中被確定,包括如BRCA1和ATM。這些被列於「DNA repair-deficiency disorder」一文中。然而,由這樣的種系突變導致的癌症僅占癌症中非常小的比例。例如,種系突變僅導致2%到5%的結腸癌病例。[115]
DNA修復基因表達的表觀遺傳減少,在散發性(非種系)癌症中非常頻繁,如在下表中顯示的,在一些代表性的散發性癌症中DNA修復基因的突變非常罕見。[116]
表中文獻如下:
1, [117]2, [118]3, [119]4, [120]5, [121]6, [122] 7, [123] 8, [124]9, [125]10, [126]11, [127]12, [128]13, [129] 14, [130]15, [131]16, [132] 17, [133]18, [134]19, [135] 20[136]
DNA修復基因表達不足導致突變率增加。如由於DNA修復基因PMS2, MLH1,MSH2,MSH3或MSH6缺陷或DNA修復基因BRCA2,[137][138]或DNA修復基因BRCA2, [139]錯配,小鼠突變率增加,同時注意到在DNA修復基因BLM有缺陷時,人類染色體重排和非整倍性有所增加。[140]因此,DNA修復缺陷可導致基因組不穩定,且這種基因組不穩定可能是導致癌症的遺傳改變的主要潛在原因。實際上,如Nowak等指出的,通過一種數學計算,很多散發性腫瘤的首要事件是一種遺傳性改變,其影響遺傳不穩定性,並且應注意到DNA修復的表觀遺傳缺陷是由體細胞遺傳的。
癌症中的組蛋白變體H2A
H2A家族的組蛋白變異體在哺乳動物中被高度保存,其通過改變染色質結構在很多調節核內過程中發揮決定性作用。其中一種主要的H2A突變體,H2A.X,標誌著DNA損傷,需要補充DNA修復蛋白來促進恢復基因組的完整性。另一種突變體,H2A.Z,在基因活化和抑制中發揮重要作用。在很多癌症中廣泛發現有高水平的H2A.Z表達,並且與細胞增殖和基因組不穩定顯著相關。[141]組蛋白變異體macroH2A1在很多類型癌症的發病機理中也很重要,例如肝癌。[142]
癌症治療
最近的研究已顯示,表觀遺傳藥物可替代當前公認的治療方法,如放射治療和化學治療,或作為輔助治療提高當前療法的效果。[143]已證明,原癌基因區的表觀遺傳控制和腫瘤抑制序列可通過組蛋白構象變化而直接影響癌症的形成和進展。[144]此外,表觀遺傳具有可逆性,是其他任何一種癌症治療法所不能提供的特性。[145]
藥物發展主要聚焦於組蛋白乙醯轉移酶(HAT)和組蛋白脫乙醯基酶(HDAC),已經上市的新藥vorinostat,是一種HDAC抑制劑,[146]其在口腔鱗狀細胞癌的進展中發揮整體作用。[147]對當前領跑的新藥靶點候選者還有組蛋白賴氨酸甲基轉移酶(KMT)和蛋白質精氨酸甲基轉移酶(PRMT)。[148]
孿生子研究
微生物中的表觀遺傳

細菌廣泛利用DNA甲基化的表觀遺傳,控制DNA-蛋白的相互作用。細菌利用DNA腺嘌呤甲基化(不是DNA胞核嘧啶甲基化)作為一種表觀遺傳信號。DNA腺嘌呤甲基化對於細菌在有機體內的毒力很重要,如大腸桿菌,沙門氏菌屬,弧菌屬,耶爾森氏菌屬,嗜血桿菌屬和布氏桿菌屬。對於甲型變形菌,腺嘌呤甲基化可調節從細胞周期和配對基因轉錄到DNA複製。對於丙型變形菌,腺嘌呤甲基化為DNA複製,染色體分離,錯配修復,噬菌體包裝,轉座酶活性和基因表達控制提供了信號。[152][153]
絲狀真菌粗糙鏈孢霉有助於理解胞核嘧啶甲基化在一個突觸的模型系統中的控制和功能。在這個有機體內,DNA甲基化抑制轉錄延伸,與RIP(重複誘導點突變)的基因組防禦系統的殘餘物和沉默基因表達有關。[154]
酵母菌感染性蛋白(PSI)由一種翻譯終止因子的某一構象改變而產生,其子細胞可繼承這種改變,並在不利條件下提供一種生存優勢。這是表觀遺傳調節使單細胞有機體能夠快速對環境應激產生反應的一個範例。朊病毒可被視為能夠誘導表型改變而不修飾基因組的表觀遺傳中介。[153]
用單分子實時排序方法可以在微生物中直接檢查表觀遺傳標誌,聚合酶的敏感性允許在測序時測量一個DNA分子的甲基化和其他修飾。[155]幾項研究已經證實,該方法具備在細菌中收集整組基因表觀遺傳資料的能力。[156][157][158][159]
方式
表觀遺傳跨代繼承[1][2](英語:transgenerational epigenetic inheritance)又稱跨代表觀遺傳、表觀遺傳隔代傳遞效應,屬於跨代表觀遺傳學的研究範圍,是指祖輩的某些基因外信息會傳遞給孫代,並在孫代的身上烙下痕跡,表現出相應的特徵。

因素
祖輩的孕期行為環境
祖輩的孕期環境、行為不僅會直接影響到子代的健康,而且可能通過生殖表觀遺傳的改變進一步影響孫代的患病風險。美國洛杉磯的一項研究發現,祖母懷孕時吸菸的兒童與母親懷孕時吸菸的兒童相比,前者發生哮喘的比例更高。研究者認為,當女性出生時,其卵巢中已經有了完整的、且一生可用的卵細胞。這意味著當母親仍在外祖母的子宮內時,就已創造好了她以後生育所需用的卵細胞,或者說就已經準備好了她子女的一半染色體。當外祖母將遺傳外信息傳遞給母親時,她也將信息傳遞給了卵細胞,這最終將為女兒提供一半DNA,而祖母吸菸可能促發幼女卵細胞的遺傳外效應。可見,父母或祖父母的特性最終可通過生殖系統傳給後代[3]。
祖輩的孕期營養
一項大鼠餵養試驗表明,F0代在妊娠期間用限制蛋白質飲食餵養,結果造成F1代和F2代血壓升高,發生了胰島素抵抗,儘管F1代在妊娠期間的營養正常[4]。一項對瑞典北部Överkalix 1890年、1905年和1920年出生的人的記錄結果顯示,如果祖父輩在其緩慢生長期間(即青春期生長發育高峰之前)吃得太多,其孫輩的糖尿病死亡率升高[5]。
相關術語
隔代遺傳,指由於基因重組導致生物體的某一性狀在間隔若干代後又重新出現的一種遺傳方式。這種遺傳病(如隱性遺傳病等)並不是每一代都出現患者,可能相隔2代或3代才出現患者。隔代遺傳是遺傳、表觀遺傳及數量遺傳共同作用的結果[6]
參見
跨代表觀遺傳是指在不改變DNA一級結構的情況下,將表觀遺傳標記和修飾從一代傳遞到多個後代。[ 1 ]因此,透過表觀遺傳機制調控基因是可以遺傳的;轉錄物和產生的蛋白質的數量可以透過遺傳的表觀遺傳變化而改變。然而,為了使表觀遺傳標記可遺傳,它們必須出現在動物的配子中,但由於植物缺乏確定的生殖系並且可以繁殖,因此任何組織中的表觀遺傳標記都可以遺傳。[ 2 ]

表觀遺傳標記在直系世代的遺傳稱為代際遺傳。[ 3 ]在雄性小鼠中,表觀遺傳訊號一直維持到F1代。[ 4 ]在雌性小鼠中,由於生殖細胞在子宮內暴露,表觀遺傳訊號得以維持至F2代。[ 4 ]許多表觀遺傳訊號在 F2/F3 世代之後遺失,不再被遺傳,因為後續代沒有暴露在與親代相同的環境中。[ 3 ]在 F2/F3 世代之後仍維持的訊號稱為跨代表觀遺傳(TEI),因為最初的環境刺激導致了表觀遺傳修飾的遺傳。[ 5 ] TEI 的幾種機制已被證明會影響種系重編程,例如跨代增加對疾病、突變和壓力遺傳的易感性。在小鼠的生殖系重編程和早期胚胎髮生過程中,甲基化標記被移除,以便開始發育,但甲基化標記會轉化為羥甲基胞嘧啶,這樣一旦基因組的該區域不再使用,它就會被識別和甲基化,[ 6 ]這可以作為該 TEI 標記的記憶。因此,在實驗室條件下,遺傳的甲基標記被移除並恢復,以確保 TEI 仍然發生。然而,在野生族群中觀察 TEI 仍處於起步階段,因為實驗室研究允許更易處理的系統。[ 7 ]
環境因素可以誘發一些受表觀遺傳影響的性狀的表觀遺傳標記(表觀遺傳標籤)。[ 1 ]這些因素包括但不限於溫度變化、資源可用性、接觸污染物、化學物質和內分泌幹擾物。[ 8 ]劑量和暴露程度可以影響環境因素對錶觀基因組的影響程度及其對後代的影響。表觀遺傳標記可以產生多種影響,包括從微小的表型變化到複雜的疾病和病症。[ 8 ]植物和人類等多細胞生物具有複雜的細胞訊號通路,這使得理解這個遺傳過程的機制變得非常困難。[ 9 ]
表觀遺傳類別
環境暴露透過影響調控和基因表現來誘發表觀遺傳變化的機制。已知表觀遺傳修飾有四大類。
- 自我維持的代謝循環,其中基因的mRNA或蛋白質產物刺激基因的轉錄白色念珠菌中的Wor1基因;
- 結構模板:使用母體的模板或支架結構複製結構。這可以包括但不限於細胞骨架結構、纖毛和鞭毛的方向和結構。纖毛蟲是這種修改的一個很好的例子。 1985 年,Beisson 和 Sonneborn 在草履蟲實驗中證明,如果切除一部分纖毛並倒置,那麼該草履蟲的後代也會在幾代中顯示出改良的纖毛結構。[ 10 ] 另一個例子是朊病毒,這種特殊的蛋白質能夠改變正常蛋白質的結構,使之與自身結構相符。朊病毒以自身為模板,然後編輯正常蛋白質的折疊以匹配其自身的折疊模式。蛋白質折疊的變化導致正常蛋白質功能的改變。這種編程的傳遞還可以改變 DNA 的染色質和組蛋白,並且可以在減數分裂過程中透過細胞質從親代傳遞到後代。[ 10 ]
- 組蛋白修飾,其中染色質的結構及其轉錄狀態受到調節。在真核細胞的細胞核中,DNA 被包裹在一種稱為染色質的 DNA-蛋白質複合物中。[ 11 ]染色質由 DNA 和核小體組成,它們結合在一起形成組蛋白八聚體。[ 12 ]組蛋白的N末端和C末端經由乙醯基(乙醯化)、磷酸基(磷酸化)、甲基(甲基化)、泛素(泛素化)和泛素樣修飾(SUMO化)基團的移除或添加進行翻譯後修飾。[ 11 ]組蛋白修飾可作為跨代表觀遺傳訊號。例如,組蛋白 H3K4 三甲基化 (H34me3) 和脂質代謝基因網絡相互作用,增加對 TEI 致肥胖作用的轉錄反應。[ 13 ]在果蠅胚胎經過幾代的熱應激暴露後,也可以觀察到 TEI 的現象。 [ 4 ]誘導的熱壓力導致異染色質組裝所必需的ATF-2 (dATF-2) 磷酸化。[ 14 ]這種表觀遺傳事件持續了多代,但隨著時間的推移,dATF-2 恢復到了正常狀態。[ 14 ]
- 非編碼和編碼 RNA,其中各種類型的 RNA 透過母體儲存的 mRNA、mRNA 翻譯 (miRNA) 和透過 RNA 幹擾途徑 (RNAi) 幹擾轉錄的小 RNA 鏈 (piRNA 和 siRNA) 參與 TEI。[ 3 ]越來越多的研究報告非編碼 RNA 對 TEI 的貢獻。例如,早期創傷小鼠的 miRNA 發生改變。[ 15 ]以早期遭受創傷、經歷不可預測的母子分離和母子壓力(MSUS)的小鼠為模型,來識別精子中改變的miRNA的影響。[ 16 ]在 MSUS 小鼠中,行為反應受到影響,胰島素水平和血糖水平降低。[ 16 ]值得注意的是,這些影響在 F2 和 F3 世代中更為嚴重。 MSUS 小鼠的大腦、血清和 F1 代精子中的 miRNA 表現下調。[ 16 ]然而,F2 代精子中的 miRNA 並沒有改變,F3 代精子中的 miRNA 保持正常。[ 16 ]這提供了支持性證據,顯示精子中 miRNA 的初始改變被轉移到表觀遺傳標記以維持傳遞。[ 17 ]在線蟲中,飢餓的誘導作用依賴於RNAi路徑的機制、微小RNA的抑制、小RNA的調控。[ 18 ]因此,飲食史的記憶是代代相傳的。[ 18 ]
表觀遺傳標記的遺傳
儘管表觀遺傳標記的遺傳形式多種多樣,但表觀遺傳標記的遺傳可以概括為透過生殖系傳播表觀遺傳訊息。[ 19 ]此外,表觀遺傳變異通常表現為四種一般形式之一,儘管還有其他形式尚未闡明。目前,自我維持反饋迴路、空間模板、染色質標記和 RNA 介導的途徑可以改變單一細胞的表觀基因。多細胞生物內的表觀遺傳變異要麼是內源性的,要麼是外源性的。[ 20 ]內源性訊號是由細胞間訊號傳導產生的(例如在發育早期的細胞分化過程中),而外源性訊號是細胞對環境因素的反應。[需要引用]
移除與保留
在有性繁殖的生物中,細胞內的大部分錶觀遺傳修飾在減數分裂過程中被重置(例如控制植物春化作用的 FLC 基因座上的標記[ 21 ]),儘管一些表觀遺傳反應已被證明是保守的(例如植物中的轉座子甲基化[ 21 ])。由於母系或父系在去除或保留機制上存在偏差,表觀遺傳標記的遺傳差異,可能導致動物[ 22 ]和植物中某些親代起源效應與表觀遺傳因果關係被歸咎於此。[ 23 ]
重新程式設計
在哺乳動物中,表觀遺傳標記在生命週期的兩個階段被消除。首先是在受精後,其次是在正在發育的原始生殖細胞中,也就是未來配子的前驅物。[ 24 ]在受精過程中,雄性配子和雌性配子以不同的細胞週期狀態和不同的基因組配置結合。男性的表觀遺傳標記被迅速稀釋。首先,與男性 DNA 相關的魚精蛋白被來自女性細胞質的組蛋白所取代,由於女性細胞質中乙醯化組蛋白的豐富程度較高,或男性 DNA 優先與乙醯化組蛋白結合,因此大多數魚精蛋白都會被乙醯化。[ 25 ] [ 26 ]其次,在許多生物體中,男性DNA系統性地去甲基化,[ 27 ] [ 28 ]可能透過5-羥甲基胞嘧啶來實現。然而,一些表觀遺傳標記,特別是母體 DNA 甲基化,可以逃脫這種重編程;導致父母印記。[需要引用]
在原始生殖細胞(PGC)中,表觀遺傳訊息被更為廣泛地抹去。然而,一些罕見位點也可以逃避 DNA 甲基化的清除。[ 29 ]如果表觀遺傳標記在合子重編程事件和 PGC 重編程事件中都能逃避擦除,那麼跨代表觀遺傳就有可能實現。[需要引用]
表觀遺傳編程對於早期胚胎髮生過程中細胞系身份的建立和固定的重要性的認識最近激發了人們對人工去除表觀遺傳編程的興趣。[ 30 ]表觀遺傳操作可能允許恢復幹細胞或更普遍的細胞的全能性,從而推廣再生醫學[需要引用]。
保留
細胞機制可能允許一些表觀遺傳標記的共同傳遞。在複製過程中,作用於前導鍊和滯後鏈的 DNA 聚合酶與 DNA 加工因子增殖細胞核抗原(PCNA)偶聯,PCNA 也與模式形成和鏈串擾有關,從而實現表觀遺傳標記的複製保真度。[ 31 ] [ 32 ]有關組蛋白修飾拷貝保真度的研究仍處於模型階段,但早期的研究表明,新組蛋白的修飾是以舊組蛋白的修飾為模式的,並且新舊組蛋白在兩條子 DNA 鏈之間隨機分配。[ 33 ]至於向下一代的轉移,如上所述,許多痕跡已被消除。新興研究正在尋找跨代表觀遺傳保育的模式。例如,著絲粒衛星能夠抵抗去甲基化。[ 34 ]儘管有證據顯示組蛋白甲基化可能起到了一定作用,但造成這種保守性的機制尚不清楚。[ 34 ] [ 35 ]研究也發現,啟動子甲基化時間失調與胚胎時期基因表現失調有關。[ 36 ]
衰變
儘管給定的 100 個鹼基基因的突變率可能是每代10−7,但表觀基因可能每代「突變」幾次,或者可能在許多世代中保持不變。[ 37 ]這就引出了一個問題:表觀基因頻率的改變是否構成演化?表觀遺傳效應對錶型的快速衰減(即持續時間少於三代)可能解釋了在考慮基因型和環境因素後表型的一些殘餘變異。然而,區分這些短期影響與母體環境對早期個體發展的影響仍然是一項挑戰。[需要引用]
TEI 範例
遺傳和表觀遺傳的相對重要性仍有爭議。儘管已經發表了數百個表型表觀遺傳修飾的例子,但在實驗室環境之外進行的研究卻很少。因此,儘管環境在自然選擇中起著核心作用,但無法推論基因與環境的相互作用。多種表觀遺傳因素會影響基因狀態並改變表觀遺傳狀態。由於環境因素的多變量性質,研究人員很難在實驗室環境之外確定表觀遺傳學變化的確切原因。[ 38 ]
在植物中
關於植物跨代表觀遺傳的研究早在1950年代就有通報。[ 39 ]最早、最典型的例子之一是玉米中的b1副突變。[ 39 ] [ 40 ] [ 41 ] [ 42 ] [ 43 ] [ 44 ] [ 45 ] [ 46 ] b1基因編碼一個鹼性螺旋-環-螺旋 轉錄因子,參與花青素生產途徑。當 b1 基因表現時,植物會在其組織內累積花青素,導致這些組織呈現紫色。 BI 等位基因(B-Intense)具有較高的 b1 表達水平,導致鞘和殼組織色素沉著較深,而 B'(發音為 B-prime)等位基因具有較低的 b1 表達水平,導致這些組織的色素沉著較低。[ 47 ]當純合子BI親代與純合子B'雜交時,所產生的F1後代均表現出低色素沉著,這是由於b1基因沉默造成的。 [ 39 ] [ 47 ]出乎意料的是,當 F1 植株自交時,所產生的 F2 代均表現出低色素沉著,且 b1 表現量也較低。此外,當任何 F2 植物(包括基因上為 BI 純合的植物)與純合 BI 雜交時,其後代都會顯示出低色素沉著和 b1 表達。[ 39 ] [ 47 ] F2 後代中缺乏深色色素個體是非孟德爾遺傳的一個例子,進一步的研究表明,BI 等位基因通過表觀遺傳機制轉化為 B'。[ 41 ] [ 42 ] B' 和 BI 等位基因被認為是表觀等位基因,因為它們在 DNA 序列水平上相同,但在DNA 甲基化、siRNA產生和細胞核內染色體相互作用水平上有所不同。 [ 45 ] [ 48 ] [ 44 ] [ 43 ]此外, RNA 介導的 DNA 甲基化途徑成分缺陷的植物在B'個體中表現出與BI類似的b1表達增加,然而,一旦這些成分恢復,植物就會恢復到低表達狀態。[ 46 ] [ 49 ] [ 50 ] [ 51 ]儘管已經觀察到從 BI 到 B' 的自發轉變,但在 50 多年的時間裡,在溫室和田間實驗中對數千株植物進行的實驗中,從未觀察到從 B' 到 BI(綠色變為紫色)的逆轉。[ 52 ]
也有報導稱,植物中存在環境誘導的跨代表觀遺傳現象。在一個案例中,與未經乾旱處理的植物相比,接受乾旱模擬處理的水稻植物在經過 11 代的暴露和單粒種子繁殖後表現出了更高的耐旱性。耐旱性的差異與整個基因組的 DNA 甲基化水平的方向性變化有關,這表明壓力引起的 DNA 甲基化模式的可遺傳變化可能對於適應反覆出現的壓力很重要。在另一項研究中,與缺乏食草壓力的植物相比,多代暴露於中度毛蟲食草的植物在後續世代中表現出對食草的抵抗力增強(以毛蟲乾重衡量)。這種對食草動物的抵抗力的增強在經過一代沒有任何食草動物接觸的生長之後仍然持續存在,這表明這種反應是跨代傳遞的。報告的結論是,RNA 指導的 DNA 甲基化途徑的組成部分與跨代抵抗力的增強有關。在多倍體植物中也觀察到了跨代表觀遺傳。基因相同的相互 F1 雜交三倍體已被證明對可行的 F2 種子發育表現出跨代表觀遺傳效應。[需要引用]
已經證明,野生蘿蔔植物(Raphanus raphanistrum)在暴露於菜青蟲(Pieris rapae)等捕食者時會誘發 TEI 。為了抵禦毛蟲的捕食,蘿蔔植株會增加硬毛葉和有毒芥子油的產量。下一代人也將會看到這種水準的提升。捕食程度的降低也會導致當前世代和後代的葉毛和毒素減少。[ 53 ]
在動物中
由於減數分裂和胚胎髮生過程中基因的重新編程,很難在動物中追蹤 TEI,尤其是在未在實驗室環境中飼養的野生族群中。必須進行進一步研究來加強對動物 TEI 的記錄。然而,確實存在一些例子。[需要引用]
誘導跨代表觀遺傳已在動物中得到證實,例如水蚤。這些微小的甲殼類動物如果在幼年時期接觸到捕食者在子宮內分泌的一種激素-利他素,就會長出保護性的頭盔。頭盔透過降低捕食者捕獲水蚤的能力來充當一種防御手段,因此頭盔的存在會降低死亡率。如果沒有利它素,D. cucullata就會長出一個小頭盔。然而,根據捕食者利他素的水平,頭盔的長度將幾乎增加一倍。下一代水蚤將會有類似的頭盔大小。如果利它素水平降低或消失,那麼第三代頭盔就會恢復到原來的尺寸。這些生物表現出適應性表型,這將影響後代的表型。[ 54 ]
對珊瑚礁魚Acanthochromis polyacanthus的基因分析提出了 TEI 應對氣候變遷的建議。隨著氣候變化,海水溫度升高。當A. polyacanthus暴露在比正常海洋溫度高出 +3°C 的水溫中時,這種魚的 193 個基因的 DNA 甲基化水平會增加,導致氧氣消耗、代謝、胰島素反應、能量產生和血管生成等功能的表型變化。 DNA甲基化的增加及其表型影響延續到了隨後的多世代。[ 55 ]
透過將雄性豚鼠 ( Cavia aperea ) 暴露在升高的環境溫度下兩個月,對可能的 TEI 進行了研究。在實驗室中,雄性被允許在高溫暴露之前和之後與同一隻雌性交配,以確定高溫是否會影響後代。由於肝臟作為體溫調節器官,因此對豚鼠父親(F0 代)的肝臟樣本以及雄性後代(F1 代)的肝臟和睪丸進行了研究。 F0 雄性對溫度升高做出了立即的表觀遺傳反應;肝臟中負責體溫調節的荷爾蒙水平升高。 F1 代在肝臟和睪丸中也表現出不同的甲基化表觀遺傳反應,顯示它們有可能將表觀遺傳標記傳遞給 F2 代。[ 56 ]
在人類中
儘管遺傳在描述表型結果時很重要,但它不能完全解釋為什麼後代與父母相似。除了基因之外,後代還會繼承前幾代人建立的類似的環境條件。人類後代在九個月的時間裡通常與母體共享的一個環境是子宮。考慮到胎兒發育階段的持續時間,母親子宮的環境會對後代的健康產生長期影響。[需要引用]
子宮內環境如何影響後代健康的一個例子是1944-45 年荷蘭的飢荒冬天及其對誘發跨代表觀遺傳疾病的因果影響。在荷蘭飢荒冬季,發育到第三個三個月時暴露於飢荒環境中的後代比飢荒前一年出生的後代體型小。此外,研究發現,飢荒期間出生的後代及其後代成年後罹患代謝疾病、心血管疾病、葡萄糖不耐症、糖尿病和肥胖症的風險增加。這場飢荒對發展的影響持續了兩代。[ 9 ] [ 57 ]荷蘭飢餓冬季期間 F1 和 F2 代健康風險因素的增加是一種已知的現象,稱為“胎兒編程”,這是由於在子宮內接觸有害環境因素引起的。[ 57 ]
在某些情況下,導致普拉德-威利症候群或安吉曼症候群的基因表現缺失被發現是由兩個等位基因的表觀遺傳變化(或「表觀突變」)引起的,而不是涉及任何基因突變。在所有 19 個資訊案例中,導致這些症候群的表觀突變與生理印記以及因此導致的另一個等位基因的沉默都位於具有特定父母和祖父母起源的染色體上。具體來說,父系衍生的染色體在SNURF-SNRPN處攜帶異常的母系標記,而該異常標記是從祖母那裡遺傳下來的。[ 58 ]
研究發現,多種癌症受到跨代表觀遺傳學的影響。在兩名具有遺傳性非息肉性結腸直腸癌表型的個體中發現了MLH1基因的表觀突變,並且沒有任何導致該疾病的明顯 MLH1 突變。在其中一個個體的精子上也發現了相同的表觀突變,顯示有可能遺傳給後代。[ 58 ]除了MLH1基因的表觀突變外,還已確定某些癌症,如乳癌,可能起源於子宮內的胎兒階段。[ 59 ]此外,利用模型系統(即動物)的多項研究收集的證據發現,父母代時期的暴露可導致乳癌的多代和跨代遺傳。[ 59 ]最近,研究發現,男性生殖細胞透過懷孕前父親的飲食進行適應,與後代發育過程中乳癌的調節之間存在關聯。[ 59 ]更具體地說,研究已經開始發現新的數據,強調乳癌的跨代表觀遺傳與祖先飲食成分或相關標誌(如出生體重)之間的關係。[ 59 ]研究表明,透過利用小鼠等模型系統,在受孕時刺激父親肥胖可在表觀遺傳學上改變父親的生殖系。父系生殖細胞負責調節女兒出生時的體重以及女兒罹患乳癌的可能性。[ 60 ]此外,研究發現,男性生殖細胞miRNA表現譜的改變與體重增加有關。[ 60 ]此外,父親肥胖會導致女性後代患致癌物誘發的乳腺腫瘤的百分比增加,而這是由乳腺 miRNA 表達的變化引起的。[ 60 ]
除了與跨代表觀遺傳的影響有關的癌症相關疾病之外,跨代表觀遺傳最近也與肺動脈高壓(PAH)的進展有關。 [ 61 ]最近的研究發現,跨代表觀遺傳可能與 PAH 的進展有關,因為目前的 PAH 治療方法無法修復與該疾病相關的不規則表型。[ 61 ]目前,PAH 的治療嘗試使用血管擴張劑和抗血栓保護劑來糾正 PAH 的症狀,但均未能有效緩解與 PAH 相關的受損表型相關的併發症。[ 61 ]血管擴張劑和抗血栓保護劑無法糾正 PAH,這表明 PAH 的進展取決於多種變量,很可能是跨代表觀遺傳的結果。[ 61 ]具體而言,人們認為跨代表觀遺傳學與血管重塑相關的表型變化有關。[ 61 ]例如,妊娠期間缺氧可能誘發跨代表觀遺傳改變,這種改變可能對胎兒發育的早期階段造成損害,並增加成年後患肺動脈高壓的可能性。[ 61 ]儘管缺氧狀態可能誘發與 PAH 相關的跨代表觀遺傳變異,但有強有力的證據表明,多種母體危險因子與 PAH 的最終進展有關。[ 61 ]與晚髮型肺動脈高壓相關的產婦危險因子包括胎盤功能障礙、高血壓、肥胖和子癇前症。[ 61 ]這些母體風險因子與環境壓力,再加上跨代表觀遺傳變化,可能導致與胎兒階段血管發育相關的訊號路徑受到長期損害,增加患 PAH 的可能性。[ 61 ]
一項研究表明,童年虐待(定義為「性接觸、嚴重身體虐待和/或嚴重忽視」)會導致糖皮質激素受體表達的表觀遺傳修飾。[ 62 ] [需要非主要來源] [ 63 ] [需要非主要來源]糖皮質激素受體表達在下丘腦-垂體-腎上腺 (HPA) 活動中起著至關重要的作用。此外,動物實驗表明,表觀遺傳變化可能取決於出生後的母嬰交互作用。[ 64 ] [需要非主要來源]此外,最近一項研究調查了懷孕期間的母親壓力與青少年及其母親的甲基化之間的相關性,發現懷孕期間遭受虐待的婦女的孩子更有可能患有甲基化的糖皮質激素受體基因。[ 65 ] [需要非主要來源]因此,攜帶甲基化糖皮質激素受體基因的兒童對壓力的反應會改變,最終導致更容易出現焦慮。[ 65 ] [需要非主要來源]
另外研究了內分泌幹擾物己烯雌酚(DES)的影響,發現接觸 DES 的女性的孫輩(第三代)患上註意力不足過動症(ADHD) 的可能性顯著增加。[ 66 ]這是因為,女性在懷孕期間接觸DES 等內分泌幹擾物可能會導致多代神經發育缺陷。[ 66 ]此外,動物研究表明,內分泌幹擾物對生殖細胞和神經發育有重大影響。[ 66 ]人們推測 DES 對多代產生影響的原因是與生殖細胞表觀遺傳重編程相關的生物過程的結果,儘管這一點尚未確定。[ 66 ]
對健身的影響
表觀遺傳只有在可預測地改變選擇下的性狀時才會影響適應性。有證據顯示環境刺激是表觀基因改變的重要因素。諷刺的是,達爾文進化論可能作用於這些新拉馬克主義獲得性特徵以及產生這些特徵的細胞機制(例如甲基轉移酶基因)。表觀遺傳可能會為能夠應對中等時間尺度環境變化的生物體帶來適應性優勢。[ 67 ]短週期變化可能具有 DNA 編碼的調節過程,因為後代在其生命週期內需要多次對變化做出反應的可能性很高。另一方面,自然選擇將作用於那些經歷較長週期環境變化的群體。在這些情況下,如果下一代的表觀遺傳啟動對大部分間隔內的適應性有害(例如有關環境的錯誤訊息),這些基因型和表觀基因型將會遺失。對於中間時間週期,後代遇到類似環境的機率足夠高,並且對缺乏能夠回應環境的遺傳結構的個體不會產生實質的選擇壓力。當然,短、中、長環境週期的絕對長度將取決於生物的特性、表觀遺傳記憶的長度和世代時間。表觀遺傳適應度效應的解釋大多集中在表觀基因是表型的重要貢獻者的假設上,但這一假設仍有待解決。[需要引用]
有害影響
遺傳的表觀遺傳標記可能對調節身體健康的重要組成部分很重要。例如,在植物中,柳穿魚的Lcyc基因控制花的對稱性。林奈首次描述了徑向對稱突變體,這種突變體是在Lcyc被嚴重甲基化時出現的。[ 68 ]鑑於花形對傳粉媒介的重要性,[ 69 ] Lcyc同源物(如CYCLOIDEA )的甲基化可能對植物的適應性產生有害影響。在動物中,大量研究表明,遺傳的表觀遺傳標記會增加患病的可能性。跨代表觀遺傳影響也被認為會導致人類疾病,尤其是癌症。[ 70 ]已證明基因啟動子的腫瘤甲基化模式與癌症家族史呈正相關。[ 71 ]此外,MSH2基因甲基化與早發性大腸直腸癌和子宮內膜癌有關。[ 72 ]
假定的適應效應
實驗中,模型生物 擬南芥的去甲基化種子具有顯著較高的死亡率、生長遲緩、開花延遲和坐果率較低,[ 73 ]顯示表觀基因可以提高適應性。此外,環境引起的對壓力的表觀遺傳反應已被證明是遺傳的,並且與適應性呈正相關。[ 74 ]在動物中,群居築巢改變了小鼠的行為,增強了父母的照顧機制[ 75 ]和社會能力[ 76 ],據推測,這可以分別提高後代的存活率和獲得資源(如食物和配偶)的機會。[需要引用]
免疫繼承
表觀遺傳學在免疫系統的調節和發展中起著至關重要的作用。[ 77 ] 2021 年,有證據表明,全身性感染白色念珠菌的小鼠後代具有跨代遺傳的訓練有素的免疫力。[ 78 ]小鼠後代透過與免疫基因位點相關的功能、轉錄和表觀遺傳學變化在白色念珠菌感染下存活下來。 [ 78 ]髓系細胞對白色念珠菌感染的反應性在發炎途徑中增強,並且在下一代中對感染的抵抗力增強。[ 78 ]脊椎動物的免疫力也可以透過荷爾蒙、營養物質和抗體的傳遞從母體轉移。[ 79 ]在哺乳動物中,母體因素可以透過哺乳或胎盤轉移。[ 79 ]免疫相關性狀的跨代傳遞在植物和無脊椎動物中也有描述。植物具有防禦啟動系統,使它們能夠產生替代防禦反應,當受到壓力作用或病原體時,這種反應可以加速。[ 80 ]啟動事件發生後,啟動壓力線索訊息儲存起來,而這種記憶可能會在後代中遺傳(代際或跨代)。[ 80 ]研究表明,感染丁香假單胞菌的擬南芥後代在系統性獲得性抗性(SAR)的表達過程中得到了引發。[ 81 ]後代表現出對(半)活體營養病原體具有抗性,這與水楊酸依賴基因和防禦調節基因、PR 基因的非表達基因(NPR1)有關。[ 81 ]子代中跨代 SAR 與組蛋白 3 賴氨酸 9 乙醯化增加、基因低甲基化以及水楊酸依賴性基因啟動子區域染色質標記有關。[ 81 ]與此類似,在昆蟲中,赤擬穀盜(Tribolium castaneum)因接觸病原體蘇雲金芽孢桿菌而引發。[ 79 ]對赤擬穀盜的雙交配實驗表明,父系跨代免疫啟動是由精子或精液介導的,這可以提高接觸病原體後的存活率,並有助於表觀遺傳變化。[ 79]]
回饋迴路和 TEI
在分子機制和穩態過程的調節中,經常觀察到正回饋迴路和負回饋迴路。有證據表明,反饋迴路相互作用以維持一代內的表觀遺傳修飾,並有助於各種生物體的 TEI,並且這些反饋迴路可以顯示對環境擾動的假定適應性。回饋迴路其實是任何表觀遺傳修飾的反響,因為它會導致表現的變化。更重要的是,由於 TEI 而跨越多代人看到的回饋迴路展示了僅與 TEI 相關的時空動態。例如,胚胎髮生過程中的溫度升高和 PIWI RNA(piRNA)的建立成正比,為透過 piRNA 簇抑制轉座因子提供了可遺傳的結果。[ 82 ]此外,後代保留了一個活性基因座,從而繼續建立piRNA,而它的形成先前一直是個謎。[ 82 ]另一種情況是,內分泌幹擾與Menidia beryllina不同基因組位點的甲基化存在回饋迴路交互作用,這可能是 TEI 的功能。[ 83 ]當移除暴露後,M. beryllina F2 後代仍然保留了這些甲基化標記,這導致對各種基因表現形成負回饋迴路。 [ 83 ]另一個例子是,鰻魚雜交可以產生回饋迴路,促進轉座子去甲基化和轉座因子活化。[ 84 ]由於 TE 通常在基因組中處於沉默狀態,它們的存在和潛在表達會形成一個反饋迴路,阻止雜交種與其他雜交種或非雜交物種繁殖,從而消除了 TE 表達的增殖,並阻止了這種情況下 TEI。這種現象稱為合子後生殖隔離的一種形式。
宏觀進化模式
遺傳表觀遺傳對細菌、原生生物、真菌、植物、線蟲和果蠅的表型的影響已被充分證實。[ 85 ] [ 19 ]雖然尚未對錶觀遺傳進行系統性的研究(大多數集中在模式生物上),但有初步證據表明,這種遺傳方式在植物中比在動物中更重要。[ 85 ]動物生殖系的早期分化可能會阻止發育後期發生的表觀遺傳標記,而在植物和真菌中,體細胞可能會被整合到生殖系中。[ 86 ] [ 87 ]
人們認為跨代表觀遺傳可以使某些群體輕鬆適應多變的環境。[ 19 ]儘管有充分的證據顯示某些群體存在跨代表觀遺傳,但人們對於這種適應性是否也適用於哺乳動物仍存在疑問。[ 19 ]更具體地說,人們質疑它是否適用於人類。[ 19 ]到目前為止,大多數利用小鼠的實驗模型和對人類的有限觀察僅發現了對兩種生物體的健康有害的表觀遺傳特徵。[ 19 ]這些有害特徵包括增加心血管疾病等疾病的風險,甚至過早死亡。[ 19 ]然而,這可能是基於有限報告偏差的前提,因為與積極的實驗效應相比,消極的實驗效應更容易被檢測到。[ 19 ]此外,生殖細胞演化成功和哺乳動物胚胎髮生的初始階段所必需的大量表觀遺傳重編程可能是限制哺乳動物染色質標記跨代遺傳的潛在原因。[ 19 ]
生活史模式也可能導致表觀遺傳的發生。固著生物、擴散能力低的生物和行為簡單的生物可能透過表觀遺傳途徑向後代傳遞訊息而受益最多。地理模式也可能出現,高度多變和高度保守的環境可能會容納較少的具有重要表觀遺傳的物種。[需要引用]
歷史與爭議
人類早已認識到父母的特徵通常會在後代身上得到體現。這種見解導致了植物和動物選擇性育種的實際應用,但並未解決遺傳的核心問題:這些特性如何在幾代之間保存,以及是什麼導致了變異?在進化思想史上曾出現過幾種不同的觀點。[需要引用]
混合繼承與顆粒繼承

在解決這些相關問題時,啟蒙運動時期的科學家主要主張混合假說,即父母的特徵在後代中趨於同質化,就像將幾桶不同顏色的油漆混合在一起一樣。[ 88 ]查爾斯‧達爾文《物種起源》的批評者指出,在這種遺傳方案下,變異很快就會被多數表型所淹沒。[ 89 ]以油漆桶的類比來看,這可以透過將兩種顏色混合在一起,然後將得到的顏色與其中一種母色混合20次來實現;稀有變體的顏色會很快褪色。[需要引用]
歐洲科學界的大多數人並不知道,僧侶格雷戈爾·孟德爾透過豌豆育種實驗解決瞭如何在世代之間保留性狀的問題。 [ 90 ] 因此,查爾斯·達爾文並不知道孟德爾提出的「顆粒遺傳」理論,即性狀不是混合的,而是以離散的單位傳遞給後代,我們現在稱之為基因。儘管達爾文的思想和孟德爾的思想直到 20 世紀 30 年代才統一,這段時期被稱為現代綜合,但達爾文還是拒絕了混合假說。[需要引用]
先天性特徵與後天性特徵的遺傳
讓-巴蒂斯特·拉馬克在 1809 年出版的《動物學哲學》一書中[ 91 ] 指出,每個物種都會因其形態和環境而經歷一系列獨特的挑戰。因此,他提出,最常用的字元會累積一種「神經液」。這些後天累積的知識將會遺傳給後代。用現代術語來說,傳遞給後代的神經液是一種表觀遺傳形式。[需要引用]
1859 年,查爾斯·達爾文和阿爾弗雷德·拉塞爾·華萊士共同提出了自然選擇進化論,拉馬克主義(這個思想體係後來被稱為拉馬克主義)成為物種隨時間變化的標準解釋。為了回應達爾文和華萊士的理論,修正後的新拉馬克主義吸引了一小部分生物學家追隨[ 92 ] ,但拉馬克主義的熱情在很大程度上被魏斯曼[ 93 ]的著名實驗所澆滅。魏斯曼在實驗中連續幾代剪掉老鼠的尾巴,而尾巴的長度卻沒有任何變化。因此,獲得性特徵不能被遺傳這一新興共識成為了經典。[ 24 ]
進化論的修正
然而,非遺傳變異和遺傳被證明相當普遍。隨著 20 世紀現代演化綜合理論(統一孟德爾遺傳學和自然選擇)的發展,CH 沃丁頓(1905–1975) 致力於統一發育生物學和遺傳學。為此,他採用了「表觀遺傳」[ 94 ]一詞來表示胚胎細胞儘管具有相同的 DNA 一級結構,但有序分化為功能不同的細胞類型。[ 95 ]研究人員只是偶爾討論一下沃丁頓的表觀遺傳學——它更像是一個包羅萬象的、令人費解的非基因遺傳性狀的概念,而不是一個推動研究進程的概念。[ 96 ] [ 97 ]因此,Waddington 字詞的定義本身也在不斷演變,其範圍超越了發育訊號傳導和遺傳細胞特化的子集。
一些科學家質疑表觀遺傳是否會損害現代綜合理論的基礎。法蘭西斯‧克里克[ 98 ]在概述分子生物學的中心法則時,簡潔地指出:「DNA由組蛋白固定,因此它可以作為被動模板,同時合成RNA和蛋白質。組蛋白中並不包含任何詳細的『資訊』。」然而,他在文章結尾處指出,「該方案解釋了目前大部分實驗結果!」事實上,表觀遺傳的出現(以及進化發展、表型已經被忽視的進化能力和進化機制。[ 99 ]
此外,表觀遺傳模式和生物體表觀遺傳密碼的演化意義與拉馬克和達爾文的演化論有關。[ 100 ]例如,拉馬克假設環境因素是導致遺傳性表型改變的原因,這支持了以下觀點:在發育的關鍵階段接觸環境因素可能導致種系表觀突變,從而增加表型變異。[ 100 ]相較之下,達爾文的理論聲稱,自然選擇透過青睞那些能夠輕鬆適應的族群,增強了族群的生存能力和維持生殖健康的能力。 [ 100 ]此理論與代際可塑性和可遺傳適應性導致的表型變異相一致。[ 100 ]
此外,一些表觀遺傳變異可能提供有益的可塑性,使得某些生物能夠適應不斷變化的環境條件。然而,代際表觀遺傳訊息的交換可能會導致表觀遺傳畸變,即偏離常態的表觀遺傳特徵。因此,親代的後代可能由於表觀遺傳異常而而易患特定疾病並降低可塑性。雖然面對新環境時迅速適應的能力可能對某些能夠快速繁殖的物種族群有益,但代溝較長的物種可能不會從這種能力中受益。如果代溝較長的物種無法適當地適應預期的環境,那麼該物種後代的生殖適應性就會降低。 [需要引用]
Edward J Steele、Robyn A Lindley 及其同事[ 101 ] [ 102 ] [ 103 ] [ 104 ] [ 105 ] FredHoyle和N. Chandra Wickramasinghe [ 106 ] [ 107 ] [ 108 ] Yongsheng Liu [ 109 ] [ 10109 ] 108 ] Yongsheng 5 ]等人對主流進化論進行了批判性討論,他們認為,直接 DNA 修飾以及剛才描述的間接修飾(即,修飾)存在邏輯上的不一致以及拉馬克遺傳效應。表觀遺傳、傳播等挑戰了演化生物學和相關領域的傳統思維。
身體記憶(BM)是一種假設,認為身體本身能夠儲存記憶,而不是只有大腦才有。雖然實驗已經證明了細胞記憶的可能性,[ 1 ]但目前還不清楚除了大腦之外的其他組織如何能夠儲存記憶。[ 2 ] [ 3 ]
BM 的現代用法傾向於將其完全置於創傷記憶的背景以及身體對回憶的反應方式中。在這方面,它與PTSD的治療息息相關。[ 4 ]
概述
彼得·萊文 (Peter Levine) 將 BM 稱為內隱記憶,或者更具體地說是程序記憶,即身體能夠自動完成而不是在意識中完成的事情。他闡明了 BM 的 3 種類型,並從創傷記憶的後果和解決角度闡述了他的研究成果:[ 5 ]
- 學習到的運動動作-可以透過大腦高階區域隨時間不斷修改的動作模式。
- 緊急反應-根深蒂固的本能行為(即戰鬥或逃跑反應等)。
- 吸引或排斥-我們被營養和生長的來源所吸引,而被傷害或毒性的來源所排斥。
尼古拉·戴蒙德(Nicola Diamond)闡述了哲學家梅洛-龐蒂的觀點,並主張BM是透過做而形成的。無論是進行身體活動或是對創傷記憶形成反應。[ 6 ]
愛德華·凱西 (Edward Casey) 將 BM 稱為“身體固有的記憶,我們如何透過身體來記憶”,而不是關於身體的記憶。[ 7 ]
湯瑪斯‧福克斯 (Thomas Fuchs) 定義了 6 種不同類型的 BM:程序性、情境性、身體間性、整合性、疼痛性和創傷記憶。他指出,它們並非嚴格意義上彼此可分離的,而是「源自身體經驗的不同維度」。[ 8 ] :12 米歇爾‧薩瑪(Michelle Summa)進一步將此定義細化為內隱記憶。一種透過身體表達的、前主題的、操作性的過去意識。[ 8 ] :30
安東尼奧·達馬西奧將這些對記憶的反應稱為軀體標記或主要以身體感覺表現出來的情緒。[ 9 ]
這些記憶通常與身體某個部位或多個部位的幻肢痛有關──身體似乎記得過去的創傷。身體記憶的概念通常與壓抑記憶的概念連結在一起,在壓抑記憶中,亂倫或性虐待的記憶可以透過身體感覺保留和恢復。[ 2 ]它也可能與幻肢感覺有關,但這種情況較不常見[ 10 ]
細胞記憶
細胞記憶 (CM) 是與 BM 平行的假設,認為記憶可以儲存在大腦外部的所有細胞中。[ 13 ]一些接受過器官移植的人相信非腦組織可以擁有記憶,儘管這被認為是不可能的。作者表示,這些故事很有趣,可能在未來引發一些嚴肅的科學研究。[ 13 ]道格拉斯·文森特在其著作《移植國度》中指出,器官移植後發現的非典型新記憶、想法、情感和偏好,與其說是正常的記憶轉移,不如說是免疫抑制藥物和手術對感知的壓力造成的。換句話說,「就像服用LSD或其他精神藥物後的糟糕體驗一樣虛幻」。[ 14 ]
細胞記憶是指細胞保留有關過去狀態、暴露或事件的資訊並相應地調整其反應的能力。這個概念支撐著各種生理和病理過程,通常由荷爾蒙途徑、回饋迴路和表觀遺傳機制介導。以下是說明細胞記憶的科學基礎的關鍵例子。
壓力和情緒記憶
下視丘-腦下垂體-腎上腺 (HPA) 軸可透過釋放皮質醇等糖皮質激素,在壓力和情緒記憶中發揮關鍵作用。皮質醇透過調節海馬活動來增強情緒記憶的鞏固,但它會損害記憶檢索。[ 15 ]研究支持這種雙重效應,顯示糖皮質激素能改善長期記憶的鞏固,特別是對於情緒訊息的鞏固,同時損害檢索過程。[ 16 ]此通路的失調與創傷後壓力症候群(PTSD)等壓力相關疾病有關,此類疾病會導致基於恐懼的記憶過度鞏固。研究表明,糖皮質激素有助於記憶編碼,但可能會損害訊息的檢索,從而在記憶形成和壓力反應之間產生動態相互作用。
最近的研究進一步闡明了慢性壓力如何影響神經網路。長期處於高皮質醇水平會減少海馬體積並抑制神經發生,從而削弱大腦形成新記憶的能力,同時強化不適應的記憶。[ 17 ]同樣的研究表明,無論是由於壓力還是醫療條件,長期暴露於皮質醇水平升高,都會導致海馬體形態發生變化,抑制神經元增殖,並減少海馬體體積。
研究表明,記憶形成和壓力反應之間的動態相互作用明顯表明,糖皮質激素有助於記憶編碼,但可能會損害訊息的檢索。[ 18 ]這種關係被認為遵循一條倒 U 形曲線,即皮質醇水平適中時記憶表現最佳,而皮質醇水平低和高時都會導致記憶受損。[ 19 ]不同皮質醇濃度下鹽皮質激素受體(MR)和糖皮質激素受體(GR)的差異活化可能解釋了壓力荷爾蒙和記憶過程之間的複雜關係。[ 20 ]
此外,糖皮質激素對記憶的影響具有時間依賴性和環境特異性。雖然皮質醇水平的急性升高可以增強新記憶(包括消退記憶)的鞏固,但長期暴露於高皮質醇水平可能會對認知功能產生不利影響。[ 21 ]這對於恐懼相關疾病的治療具有重要意義,因為以糖皮質激素為基礎的干預措施可以透過減少厭惡記憶的檢索和增強消退記憶的鞏固來促進恐懼消退。[ 22 ]
代謝記憶和營養狀態
營養和代謝狀態透過荷爾蒙和轉錄機制編碼在細胞記憶中,包括葡萄糖誘導的轉錄滯後和甲狀腺激素調節。長期高血糖可引起葡萄糖調節途徑的持久表觀遺傳學變化,導致糖尿病的長期併發症,如血管損傷和認知能力下降。[ 23 ]這種現象稱為“代謝記憶”,即使在血糖水平恢復正常之後,基因表現和細胞功能仍會持續改變。[ 24 ]
葡萄糖誘導的轉錄滯後在此過程中扮演重要角色。研究表明,暴露於升高的葡萄糖水平會導致正回饋迴路,從而導致促進糖酵解和抑制替代代謝途徑的基因持續表達。[ 25 ]
類似地,在熱量不足期間,身體會透過降低基礎代謝率並透過改變瘦素、生長素釋放肽和甲狀腺激素信號來「記住」之前的能量缺乏狀態來進行適應。這些適應性反應是代謝記憶的例子,並強調了先前的營養環境如何塑造細胞行為。[ 26 ]
荷爾蒙狀態下的「記憶」概念對於維持代謝穩態確實至關重要,但在某些情況下也會導致適應不良的結果。研究表明,慢性高血糖會改變表觀遺傳標記,導致持續的血管發炎和氧化壓力。短暫性高血糖可誘導主動脈內皮細胞核因子 κB(NF-κB)亞基 p65 啟動子的長期活化表觀遺傳學變化。[ 27 ]這些變化在隨後的正常血糖水平下持續至少 6 天,導致促炎基因(如單核細胞趨化蛋白 1 (MCP-1) 和血管細胞黏附分子 1 (VCAM-1))表達增加。[ 28 ]
這些表觀遺傳學變化的建立可能先於心血管併發症出現,並有助於預測糖尿病患者的血管病變。[ 29 ]重要的是,這些表觀遺傳標記可能會跨幾代傳遞,從而增加個體患病的風險。[ 30 ]
代謝記憶的概念不僅限於葡萄糖調節。營養和代謝狀態透過各種荷爾蒙和轉錄機制編碼在細胞記憶中。[ 31 ]這些機制形成了一個控制代謝記憶的複雜網絡,並且可以成為檢測和乾預代謝疾病的新標靶。[ 32 ]
生殖和發育程式設計
青春期或懷孕等關鍵發育時期的荷爾蒙波動會對細胞和系統生理產生持久的影響。這些荷爾蒙效應會影響認知功能、第二性徵以及對荷爾蒙敏感性疾病的易感性。
早期雌激素暴露與大腦可塑性和記憶能力的長期變化有關,導致神經精神疾病的性別差異。雌激素在大腦發育中起著至關重要的作用,特別是在決定中樞性別二態性方面。[ 33 ]在青春期和其他發育階段,雌激素誘導的突觸可塑性明顯,影響神經傳導物質的合成、釋放和代謝。[ 34 ]
雌激素對中樞神經系統的影響是多方面的,涉及基因組和非基因組機制。這些作用可防止多種神經毒性損傷,並影響電興奮性、突觸功能和形態特徵。[ 35 ]臨床證據表明,更年期停止服用雌激素會導致情緒、行為和認知能力的改變,而補充雌激素可以提高停經後婦女的認知效率。[ 36 ]
新興研究確實表明,青春期睪酮水平會影響神經發育,影響前額葉皮質的突觸修剪和髓鞘形成。這些變化對決策、風險評估和情緒調節有長期影響。在青少年時期,高睪固酮水平與前額葉皮質 (aPFC) 在情緒控制中的參與度增加有關。[ 37 ]
研究表明,母親壓力期間糖皮質激素水平升高會改變胎兒的表觀遺傳標記。母親懷孕期間的逆境,包括壓力、焦慮和憂鬱,與母親和胎兒糖皮質激素濃度升高有關,這可能導致後代長期的生理和病理生理後果。[ 38 ]研究發現,母親的社會心理壓力與後代人類糖皮質激素受體基因 NR3C1 外顯子 1F 上特定 CpG 位點的甲基化之間存在顯著相關性,這可能導致後代易患情緒障礙和代謝失調。[ 39 ]
扁形蟲
塔夫茨大學的生物學家儘管失去了大腦和頭部,卻仍能訓練扁形蟲。這可能表示某些動物的記憶儲存在身體的其他部位。[ 40 ]當一條扁蟲縮小到原來的二百七十九分之一時,它能在幾週內重新長出來,並能更快地被訓練去尋找光線和開闊的空間來覓食,這對扁蟲來說是一種非自然的行為。隨著每個頭的移除,訓練時間似乎減少了。這可能只是表觀遺傳學顯示記憶出現的一個跡象。 [ 41 ]
然而,在 1950 年代和 1960 年代,詹姆斯·麥康奈爾 (James McConnell) 的扁蟲實驗測量了學習迷宮所需的時間。麥康奈爾訓練一些蠕蟲在迷宮中移動,然後將它們切碎並餵給未經訓練的蠕蟲。與沒有餵食訓練過的蠕蟲的對照組相比,未經訓練的組學得更快。麥康奈爾認為實驗顯示了細胞記憶的存在。[ 42 ]訓練包括用電擊對線蟲施加壓力。這種壓力會釋放持久的激素,並且沒有顯示出記憶轉移的跡象。在類似的實驗中,經過訓練的老鼠和未經訓練的老鼠的飼料也表明,它們的學習能力得到了改善。被轉移的並不是記憶,而是富含荷爾蒙的組織。[ 42 ]
目前的使用和研究
在表觀遺傳學中,細胞有各種機制將壓力源的「記憶」傳遞給後代。策略包括 Msn2 核質穿梭、染色質的變化、抗壓力因子的分配以及母細胞和子細胞之間的大分子受損。[ 43 ]
在適應性免疫中,存在一種功能性CM,它使免疫系統能夠透過各種機制學習對病原體作出反應,這些機制包括骨髓中的細胞毒性記憶介導[ 44 ] 、基質細胞中的先天免疫記憶[ 45 ] 、真菌介導的先天和遺傳免疫反應[ 46 ],以及T細胞和B細胞免疫訓練。[ 47 ]在這方面,CM對於疫苗和免疫研究 至關重要。
沒有留言:
張貼留言
Love the Lord your God with all your heart and with all your soul and with all your mind.
耶 穌 對 他 說 : 你 要 盡 心 、 盡 性 、 盡 意 愛 主 ─ 你 的 神 。
—— Matthew 22:37 —— 馬 太 福 音 22:37